1. 탄화수소
가. 탄화수소의 특징

▣ 탄소와 수소로 이루어진 탄화수소는 그 종류가 무궁무진하다.
▣ 탄소와 수소의 결합은 분자 구조에서 알아 보았듯이 단일결합, 이중결합, 삼중결합 방식을 통해 다양하게
결합을 하므로 화합물의 종류가 무궁무진하다.
나. 탄화수소의 종류
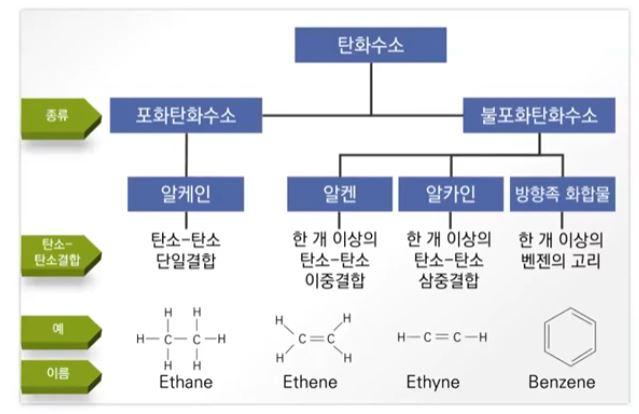
▣ 탄화수소 화합물은 포화탄화수소와 불포화 탄화수로 나뉜다.
포화탄화수소는 단일결합으로만 이루어진 화합물을 말하고 불포화탄화수소는 탄소와 탄소간 결합이 단일결합이
아니고 이중결합이 하나 있으면 알켄, 삼중결합이 하나 있으면 알카인, 이중, 단일결합처럼 보이지만
실제로는 1.5중 결합이 6개 있는 것처럼 되어 있는 방향족 화합물이 있고 이런 고리를 '벤젠고리'라고 한다.
알케인에는 사이클로 알케인이 있는데 사이클로는 고리라는 의미가 있다.
탄소와 탄소 간에 단일결합이 있지만 이들이 고리를 형성하는 것이 사이클로 알케인 화합물이다.
2. 포화탄화수소 (Saturated hydrocarbon)
가. 알케인 (Alkane) : 사슬형 포화탄화수소
'원자간의 결합이 안정하여 반응성이 작고 연료로 사용하는 경우가 많음"
※ -yl (alkyl) : 알케인에서 수소원자 하나가 없는 부분, 다른 원자들과 결합하는 가지의 역할을 함
eg. 메틸 (methyl) : CH3 -

▣ 포화 탄화수소는 안정적이다.
포화탄화수소는 탄소와 탄소가 단일결합으로 이루어져 있는데 이 결합을 끊는데 필요한 에너지가 347 정도이다.
그런데 이중결합은 1몰 [mol]을 끊는데 620의 에너지가 필요하다.
또한 삼중결합은 1몰 [mol]을 끊는데 810 이 필요하니까 결합하나 당 끊는데 필요한 에너지가 포화탄화수소의 경우가
가장 크다.
따라서 화학반응이 어려워 반응성이 작아 반응성이 좋은 물질인 산소와는 결합을 하므로 태우는 원료로 사용된다.
▣ 이름의 부를 때, 탄소가 하나면 '메타' 2개면 '에타' 3개면 '프로파' 4개면 부탄가스이 '부타'라고 하고 5개면 '펜타' 6개
'헥사', 7개 '헵사', 8개 '옥타', 9개 '노나', 10개 '데카' 라 부른다.
※ thane(테인)은 영어식이고 thane(탄)은 독일어식 이다.
▣ 이름에 'yle'이 붙으면 알케인에서 수소원자 하나가 없는 부분으로 이들을 알킬 그룹(Alkyle group)이라고 하는데
메탄(CH4)에서 수소원자 하나가 없어지면 다른 원소와 결합할 수 있는데 이렇게 결합 하나가 비어 있으면
'메틸(methyle)'이라고 부른다.
▣ 여기에 OH가 붙어 결합한 화합물을 알코올이라고 한다. 메틸과 붙으면 메틸 알코올, 에틸과 붙으면 에틸알코올,
프로필과 붙으면 프로필 알코올이 된다.
나. 알케인 (alkane) : 사슬형 포화 탄화수소

▣ 메탄, 에탄, 프로판은 상온에서 기체이다. 천연가스의 주성분인 메테인은 메탄가스, 천연가스, 도시가스라고도 부른다.
프로테인과 부테인을 합하여 LPG 가스라고 한다.
* LPG : Liqufied Petoleum Gas 의 약자로 우리말로는 '액화석유가스'라는 의미이다.
휘발유 성분인 펜테인, 헥세인, 헵테인이 있다. 또한 옥테인, 데케인, 도데케인까지 있는데 옥탄(옥테인)은 탄소
가 8개가 있는데 이는 엔진 속에서 성능이 제일 좋아 노킹도 일어나지 않고 휘발유와 고급 휘발유로 나누는 기준
이 된다. Octane value (옥탄가)가 보통 97[%] 정도면 보통휘발유, Octane value가 100[%] - 순수한 물질과 마찬
가지 - 이면 이를 고급 휘발유라고 한다.
탄소 성분이 많아지면 경유라고 디젤연료의 성분이 되고 탄소의 개수가 20개인 이 화합물을 '에코센' 이라고 한다.
탄소 개수가 적으면(1~4개) 기체, 조금 많으면(5~16개) 액체, 탄소개수가 더 많아지면 고체 - 파라핀 왁스 (일반적으로
양초)가 되는데 에코센은 바세린 - 페트롤륨 젤리(Petroleum jelly)도 있다.
다. 구조 이성질체
"분자식은 같지만 원자가 결합 순서가 달라서 물리적, 화학적 성질이 달리 나타나는 분자"

▣ 포화탄화수소에는 특이한 케이스가 있다.
이성질체 - 다른 성질을 가진 물질 - 구조이성질체는 분자구조는 똑 같은데 화학적·물리적 성질이 다른 물질이다.
분자식 중에서 결합순서가 달라서 이런 현상이 나타난다.
부테인은 탄소 4개가 한 줄로 들어가지만 탄소 3개가 한 줄로 그 옆에 탄소 하나가 들어 갈 수도 있다.
이렇게 되면 분자 전체 구조가 달라지는데 일반적으로 구(球)는 도형 중에서 표면적이 가장 작은데
메테인은 탄소화 수소로만 결합되어 무극성 분자인데 메테인은 길쭉한 모양이어서 분자의 충돌 등으로 인한
분산력으로 전자가 쏠려서 극성 성질이 나타나는 반면 메틸 프로페인은 동글동글해서 전자가 잘 쏠리지 않아
그런 성질이 나타나지 않는다.
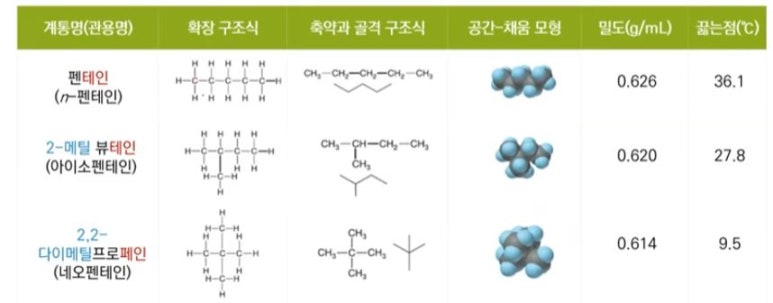
이성질체 하나더 예를 들면 펜테인은 탄소가 5개 인데 탄소가 한 줄로 5개 결합될 수도 있고 탄소 한 줄로 4개와 이들
탄소 원자 위·아래에 탄소 하나가 결합될 수도 있으며 탄소 3개가 한 줄로 결합되고 이들 탄소 결합 위·아래로 탄소 2개
가 결합할 수도 있다.
이렇게 탄소원자가 위·아래로 결합하면 분자의 표면적이 작아져서 분자의 물리적, 화학적 성질이 달라지게 된다.
예전에는 '노말', '아이소', '네오' 이런 식으로 이름을 붙였었다.
다. 사이클로 알케인 : 고리형 포화탄화수소
▣ 전자구름이나 원소의 결합각은 사면체의 결합각인 109.5° 를 선호하므로 사이클로 펜테인 부터 안정된다.
★ 사이클로 프로테인 (b.p. -32.7[℃])과 산소의 혼합 기체
▣ 휘발성, 가연성 기체로 작용이 신속하고 회복이 빠른 마취제
▣ 영유아, 중환자의 수술에 유용하나 폭발 위험 감소를 위해 헬륨 기체와 혼합 사용

▣ 메테인은 전자구름간 반발력으로 결합각 109.5° 일 때 안정이라고 했다. 고리형 탄화수소가 고리를 만들려면 탄소원자
가 3개 이상이 되어야 하는데 탄소가 3개이면 결합각이 60°, 4개면 결합각이 90°인데 이들은 109.5° 보다 결합각이
작아 불안전한 상태가 되기 때문에 연결 고리가 쉽게 떨어지게 된다. 오각형은 결합각이 좀더 커지게 되며 결합각이
108° 정도 되니까 안정해진다.
▣ 사이클로 프로테인이나 사이클로 뷰테인은 불안정한데 사이클로 프로페인은 휘발성이 있고 불에 잘타는 기체인데
우리 몸에 흡수되면 마취시키는 효과가 있다. 기체 물질로 불안정하니까 잘 쪼개지기도 하고 몸에 흡수되면 탄소와
수소로만 되어 있어서 무극성 분자니까 혈액에 과다 흡수되면 녹아서 마취성분이 나타나고 물에 잘 녹지 않으니까
바로 증발되어서 불안정하니까 쪼개지기 때문에 바로 바로 분해되어 작용이 빠르지만 회복도 빠르게 된다.
짧은 시간 마취하는 수술(10분, 20분), 영유아나 중환자 등의 마취에 사용한다.
사이클로 헥사인은 정육각형이라고 생각하지만 탄소 사면체에 위·아래로 탄소가 2개 있는 의자 모양, 탄소 사면체에
탄소가 2개가 위쪽 또는 아래 쪽에 있는 배모양의 분자 구조도 있다.
5. 불포화 탄화수소 (Unsaturated Hydrocarbon)
가. 알켄 (alkane)
"이중 결합 하나를 가진 불포화 탄화수소"

▣ 불포화 탄화수소 중 가장 간단한 알켄계열은 이중결합이 딱 하나만 있는 경우이다.
▣ 에텐(에틸렌)을 예로 들면, 이 물질은 묘목의 성장을 제어하고 열매 숙성을 조절하는 일명 '숙성 호르몬'이다.
감을 보면 홍시, 연시가 있는데 이 상태로 유통시키면 말랑말랑해서 터지기 쉽상이여 덜 익은 상태로 유통시키고
집에서 익혀서 먹든지 할 때 에텐이 나오는 물질을 조금 넣으면 감이 잘 익게 된다.
▣ 에텐, 에틸렌을 쭉 연결하면 '폴리(Poly-)라는 말이 붙어 '폴리에틸렌' 고분자 화합물이 되고 플라스틱, 비닐이 된다.
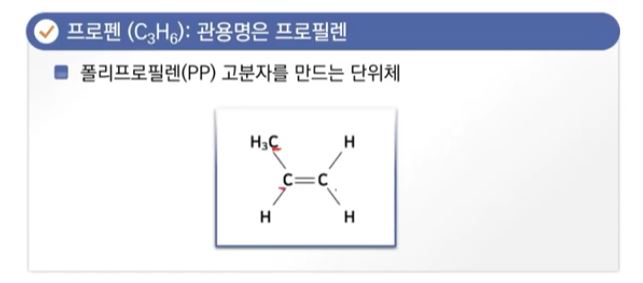
▣ 마찬가지로 폴리 프로틸렌도 같은 계열이 될 수 있다.
나. 시스/트랜스 이성질 현상

▣ 단일 결합은 회전이 되는데 이중결합, 삼중결합은 회전결합이 안된다. 시스형은 이중결합을 기준으로 긴 탄소사슬이
같은 쪽에 있는 것이고 트렌스형은 이중 결합을 기준으로 긴 탄소사슬이 반대쪽에 있는 것이다.
따라서 시스형은 전자가 한쪽으로 쏠리고 트랜스형은 반대로 한쪽에 전자가 솔리면 전자구름의 반발력 때문에 다른
전자구름을 반대쪽으로 밀면서 대칭적으로 있게 되므로 시스형은 플러스(+), 마이너스(-)가 생기고 트랜스형은 극성이
나타나지 않는다.
따라서 시스형은 분자간에 인력이 발생하여 끓는점이 높고 트랜스형은 분자간에 인력이 약해서 끓는 점이 낮아진다.
이들 시스/트랜스형 이성질 현상도 이성질체의 한 종류다. 이중 결합이 있는 이성질체라고 할 수 있다.
다. 알카인 (Alkyne)
"삼중 결합을 하나 가진 불포화 탄화수소"

▣ 삼중결합을 하나 갖은 불포화 탄화수소를 알카인(alkyne)이라고 한다.
삼중결합을 갖는 유기화합물은 너무 불안정하여 많은 물질이 있지 않다.
이중에서 '에타인(C2H2)가 있는데 관용적으로 '아세틸렌'이라고 한다.
▣ 분자구조는 아래와 같다.

※ 단일결합을 끊을 때는 1몰[mol] 당 에너지가 350이 필요했을 때, 두번째 결합은 270의 에너지가 필요하고 세번째 결합
은 190의 에너지가 필요하다. 삼중결합을 하는 알카인 즉 에타인 - 아세틸렌(관용명)은 삼중결합이 다 끊어지는 것은
잘 발생하지 않지만 제일 불안정한 끊는데 190의 에너지가 필요한 세번째 결합은 190의 에너지만 주어지면 끊어지므
로 이 결합은 쉽게 끊어질 수 있고 이 결합이 끊어지면 다른 물질과결합을 할 수 있게 되어 반응성이 좋다.
또한 아세틸렌이 산소와 결합하면 연소하게 되는데 연소할 때 온도가 3000[℃]가 된다. 태양은 표면온도가 약 6000[℃]
가 되는데 3000[℃]라고 하면 태양보다 좀 약한 별의 온도와 마찬가지인 것이다.
굉장히 높은 온도를 내는 것이라서 쇠도 순간적으로 녹여 다시 붙게 할 수 있는 특징이 있다. 이런 성질
때문에 용접할 때 불꽃으로 사용이 된다. 공사현장에서 용접 불꽃이 튀어서 화재가 발생하곤 하는데
3000[℃]의 불꽃이 튄다고 생각하면 된다. 이런 이유로 다른 물질 보다 매우 위험한 물질로 취급된다.
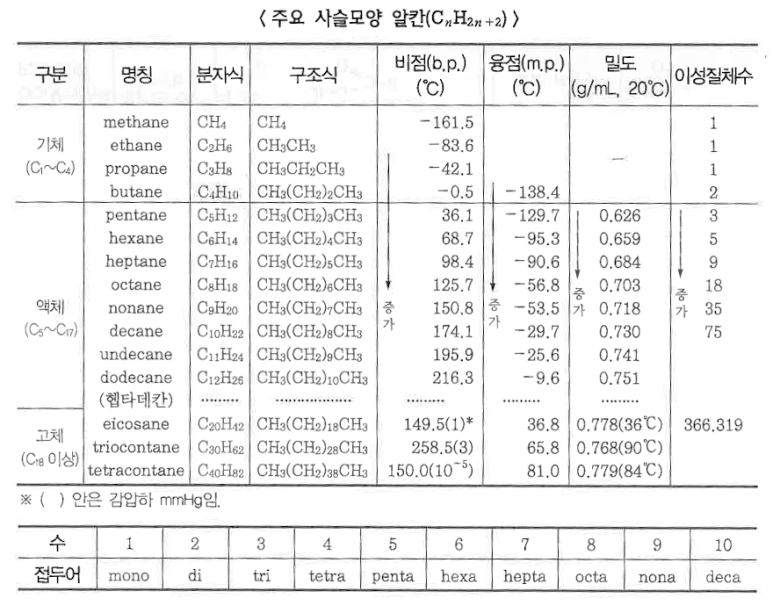
3. 알칸
가. 알칸을 이용한 IUPAC 명령법
▣ 알칸류는 모두 단일결합 (C-C, C-H)으로 이루어 졌으며, 탄소원자는 sp3 혼성궤도이다. 사슬 모양(鎖狀) 알칸의 분자
식은 일반식 CnH2n+2 로 나타내며 그 중에서 분자량이 가장 작은 (n=1) 것은 메탄(CH4)이다. 그리고 에탄 (C2H6),
프로판 (C3H8), 부탄 (C4H10)과 같이 CH2의 단위가 증가함에 따라서 기체로 부터 액체 · 고체로 물리적 성질도
변한다.
① 분자 중에서 가장 긴 탄소사슬을 골라 그 탄소사슬의 알칸 명칭을 모체로 하여 명명하고 치환기를 갖는 것은 그 화합물
의 유도체로 생각한다.
② 치환기의 결합 위치를 탄소번호로 나타낸다. 이 때 번호의 숫자가 가능한 한 작게 되도록 모체 알칸의 어느 안쪽으로
부터 번호를 붙인다.
③ 치환기가 있는 화합물의 명칭은 모체가 되는 탄소사슬의 명칭 앞에 치환기의 이름을 붙인다.
④ 같은 치환기가 분자 중에 2개 이상 있을 경우는 그 수를 접두어인 디 (di = 2), 트리(tri- = 3), 테트라 (tetra - = 4) 등을
사용하여 표시한다. 또한 2개 이상의 치환기가 같은 탄소에 결합되어 있는 경우에는 그 탄소번호 사이에 ','를 붙이고
이어서 붙여 나간다. 접두어는 알파벳 순을 고려하지 않아도 된다.
⑤ 모체가 되는 가장 긴 사슬이 여러 개 있는 경우에는 치환 정도가 가장 높은 것을 우선하여 명명한다.
⑥ 아이소프로판, 아이소부탄, 아이소펜탄, 네어펜탄 등과 같이 관용어로 불려지는 알칸이 치환기로 되는 경우에는 아이
소프로필기, 아이소뷰틸기, 아이소펜틸기, 네어펜틸기 등으로 부른다.
⑦ 할로겐 치환기는 어미 인(ine)을 오 (-o)로 명명한다.
F (fluoro), Cl (Chloro), Br (Bromo), I (iodo)

나. 알칸의 물리적 성질
① 알칸의 특성은 비극성 (nonpolar)이므로 비점 (b.p. : 끓는 점)과 융점 (m.p. : 녹는점)이 다른 극성 (polar)이 있는 화합물
에 비하여 낮아진다.
② 실온에서 탄소수가 적은 C1의 메탄에서 C4의 부탄까지는 기체이고, C5에서 C17까지는 액체이며, 탄소수가 많은
C18 이상은 고체이다.
③ 물에 대한 용해도 (Solubility)는 비극성 때문에 대단히 낮고, 가장 높은 메탄인 경우에는 물 100 ㎖ 중에 0.0025g 밖에
용해되지 않는다.
④ 알칸은 물에는 불용해성이지만 비극성인 알칸, 알켄, 벤젠 등의 탄화수소에는 잘 용해되고 사염화탄소 (CCl4), 클로로
프름 (CHCl3), 염화메틸렌 (CH2Cl2) 등의 염소계 유기화합물에도 잘 녹는다.
"비슷한 물질 끼리는 잘 녹는다"라고 하는 일반 법칙이 잘 맞으며 이것은 극성에 관계된다.
⑤ 알칸의 화학적 특징은 일반적으로 반응성이 낮고 불활성인 것이다. 알칸은 파라핀 ( paraffin)이라고도 한다.
⑥ 알칸은 실내온도 조건하에서 알칼리, 산, 과망가니즈산칼륨, 금속 나트륨 등과는 반응하지 않는다.
그러나 조건을 강하게 하면 독특한 반응을 일으키기도 한다.
다. 알칸의 반응
① 알칸의 할로겐화 : 보통의 조건하에서 알칸은 할로겐에 의하여 할로겐화 (Halogenation) 되지 않는다.
그러나 알칸 및 할로겐을 가열하거나 자외선 (ultraviolet ray)을 비춰주면 반응이
개시되고 알칸의 수소 1원자가 할로겐 1원자와 치환반응 (Substitution reaction)을
일으킨다. 이 때에 할로겐화수소가 1분자 생성된다.

여기에서 X는 할로겐을 나타내며 알칸이 할로겐 분자와 반응하는 속도는 F2 ≫ Cl2 > Br2 > I2의 순이다.
② 알칸의 산화 : 알칸은 고온하에서 산소화 반응하여 이산화탄소와 물을 생성한다. 이 산화반응(Oxidation reaction)을
일반적으로 연소 (Combustion)라고 하는데 발열반응 (發熱 反應)이다.
알칸의 methylene기 ( - CH2 -) 1개당 약 160 kcal/mol 의 열을 방출한다.

③ 알칸의 열분해 : 석유의 높은 끓는 점 유분 (留分)의 긴 사슬알칸을 고압하에서 가열 (500 ~700 ℃)하여 저분자량의
알칸이나 알켄으로 변화하는 방법을 가열크래킹 (Cracking)이하고 하는데 프로판의 열분해
(Thermolysis)에서는 프로필렌, 에틸렌, 메탄, 수소가 각각 생성된다.
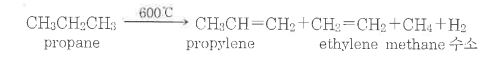
4. 고리모양 알칸
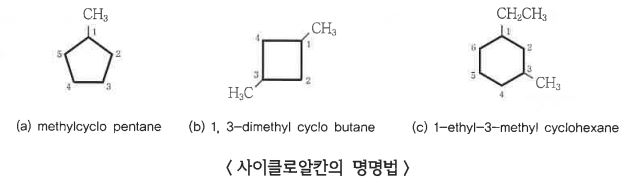
가. 고리모양 알칸의 명명법
▣ 고리모양 알칸의 명명은 알칸과 같으며, 고리를 형성하고 있는 탄소수를 모체의 이름으로 하고, 그 앞에 고리를 나타내
는 접두어 사이클로 (Cyclo)를 붙인다.

▣ 치환기가 1개 있는 경우에는 치환기의 명칭을 먼저 붙이고 사이클로알칸을 명명한다. 치환기가 2개 이상 있는 경우에
는 알파벳 순으로 치환기 명칭을 배열한 후 최초 치환기가 붙어 있는 탄소원자를 C1으로 하고, 다른 치환기가 붙는
번호를 가급적 작게 하는 방향으로 고리에 따라서 번호를 붙인다.
나. 고리모양 알칸의 변형과 형태
▣ 2종 화합물의 C - C 결합은 약하고 수소첨가에 의하여 용이하게 환원되어 고리가 열려 사슬알칸이 된다.
사이클로프로판이 사이클로부탄보다 쉬운 조건에서 개환하는 것은 그 만큼 변형이 크다는 것이다.

5. 알켄
가. 알켄
▣ 지방족 불포화탄화수소 중에 탄소 - 탄소 이중결합을 갖는 유기화합물을 알켄 (Alkene 또는 Olefine) 이라고 총칭한다.

나. 알켄의 명명법

① 2중 결합을 가진 가장 긴 탄소사슬을 모체로 정한다.
② 모체의 탄소사슬에 대응하는 알칸의 명칭을 선정하여 그 어미의 '안(-ane)'을 '엔(-ene)'으로 표시한다.
③ 2중 결합을 형성하는 탄소의 번호가 가장 작게 되도록 모체의 탄소사슬에 번호를 붙인다.
④ 2중 결합의 위치는 2중 결합을 형성하는 최초의 탄소번호로서 표시한다. 따라서 위의 예에서는 좌측에서 번호를 붙이
고 모체는 2-hepene이 된다. 5 - heptene (우측에서 번호를 붙일 경우)이라고 해서는 안된다.
⑤ 모체에 결합되어 있는 치환기의 위치는 결합된 탄소의 번호를 그 치환기 및 명칭 앞에 붙인다. 치환기는 알파벳 순으로
배열한다.
앞의 예에선은 2, 5 - dimethyl이 되며, 그 화합물의 IUPAC 명칭은 2, 5 - dimethyl - 2 - heptene 이 된다.
옆 사슬기는 일반적 방법으로 명명한다.
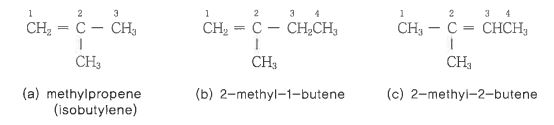
다음 예에서 규칙들이 어떻게 적용되는지를 알 수 있다.

다. 알켄의 이성질체
▣ 분자식이 C4H8인 butene (=butylene)의 구조식을 보면, 다음 그림에서와 같이 4개의 탄소원자가 직쇄상으로 배열된
구조인 것 3종 [그림의 (a), (b), (c)]과 가지가 있는 구조인 것 1종 [그림의 (d)] 등이 있다.
이러한 4종은 서로 이성질체이다.
▣ 그 중에서 (a)와 (b) · (c)는 이중 결합 위치가 서로 다르며, 이것을 위치 이성질체 (positional isomer)라고 한다.
또 (b)와 (c)는 2중 결합에 대하여 치환기 또는 치환원자가 공간적으로 서로 다른 위치에 있는 이성질체로서
이것을 기하 이성질체(geometric isomer) 또는 시스트란스 이성질체 (cistrans isomer)라고 한다.
즉, 치환기가 2중 결합을 중심으로 같은 쪽에 있는 것을 시스화합물 (ciscompound)이라 하고, 반대쪽에 있는 것을
트란스화합물 (transcompound)이라고 한다.

라. 알켄의 반응
① 수소의 첨가반응 : 여러가지 촉매 (Ni, Pd, Pt)를 사용하여 수소 분자를 탄소 - 탄소 2중 결합 위치에 첨가시킨다.
② 할로겐의 첨가반응 : 염소 또는 브로민이 2중 결합의 탄소에 첨가되어 배치되는 (vicina) 디할로겐화 알킬을 생성한다.
6. 알킨의 명명법 및 반응
▣ 알킨은 탄소 - 탄소 3중 결합을 갖는 화합물류를 말하며, 일반적으로 CnH2n-2 로 표시된다.
가. 알킨의 명명법
▣ 알킨의 명명법은 알칸 또는 알켄에 준하지만 탄소사슬 모체의 어미에 3중 결합을 나타내는 '인(-yne)'을 붙인다.
예를 들면, 탄소사슬이 4인 화합물은 부틴 (butyne)이 되고 탄소사슬이 6인 화합물은 헥신(hexyne)이 된다.
또 다음의 예에서와 같이 치환기가 붙어 있는 화합물은 4 - ethyl - 6 methyl - 2 - octyne이 된다.

나. 알킨의 반응
① 수소의 첨가 : 알킨에 백금, 니켈, 파라듐 등의 촉매를 사용하여 수소를 첨가하면 최종 생성물로서 알칸이 얻어진다.
또한 활성을 저하시키는 촉매(觸媒), 예를들면, Pd/BaSO4 또는 Pd/Pb(OCOCH3)2 등을 사용하면
1 mol의 수소만을 흡수하고 반응이 정지되며 cis - 알켄이 생성된다.
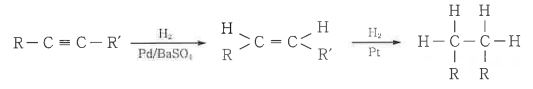
② 할로겐의 첨가 : 탄소 - 탄소 3중 결합에 2mol의 할로겐을 첨가하면 1, 1, 2, 2- 테트라할로겐화합물이 된다.
일반적으로 염소와 브로민이 반응을 잘 한다.
다. 알칸 (CnH2n+2), 알켄 (CnH2n), 알킨 (CnH2n-2)의 특징 비교

#알칸 #에탄 #메탄 #프로판 #부탄 #테트라 #알켄 #이성질체 #알킨 #할로겐 #치환기 #탄소사슬
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 반응속도와 화학평형 (4) | 2024.11.21 |
|---|---|
| 유기화합물 - 방향족 및 지방족 화합물 (0) | 2024.11.20 |
| 유기화합물 - 1 (4) | 2024.11.18 |
| 무기화합물 (0) | 2024.11.18 |
| 산화 · 환원 반응 (화학반응) (6) | 2024.11.17 |