1. 유기화학 (Organic chemistry) vs 무기화학 (Inorganic ch.)
가. 유기화합물의 예
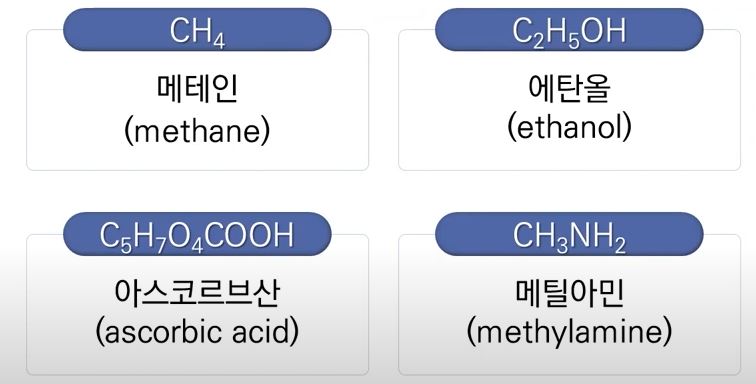
▣ 유기화합물에 공통적으로 들어 있는 원소들은 수소와 탄소가 들어 있다.
그리고 일부에서는 산소와 질소가 들어 있다.
▣ 이와 같이 유기화합물은 탄소와 수소가 결합된 것이 기본이다.
나. 유기(Organic) 이란 ?
▣ 일반적으로 유기농이라고 할 때 유기라는 말은 농사를 지을 때 유기물, 즉 생물로 부터 얻어지는 비료를 사용했다는 것
을 의미한다. 즉, 유기라는 뜻은 '생물로 부터 얻어지는' 의 뜻이 있다. 다른 의미로는 동물의 배설물 등을 의미한다.
▣ 유기물을 분류하는 이유는 유기물은 실험실에서 인위적으로 합성한 물질이 아니라 생물이 있어야 얻어지는 물질이란
의미로 유기물을 분류한 것이며 유기 (有機)라는 이름으로 유기화학의 분야를 형성한다.
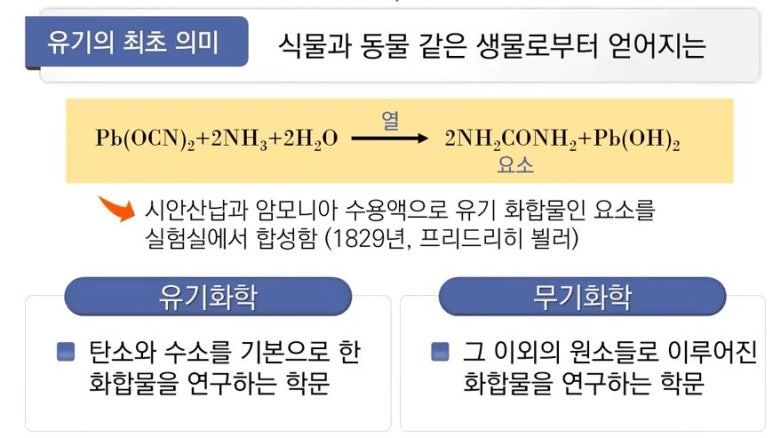
▣ 1829년 프리드리히 뵐러 (Friedrich Wohler)가 중요한 일을 하죠. 시안산납과 암모니아를 결합하여 유기화합물을 만든
다. 우리 몸에 신장에서 질소를 배설하기 위해 만들어지는 화합물인 '요소'는 동물만이 만들 수 있다고 여겨졌는데
실험실에서 만들기 시작한 것이다. 이후로 부터는 '유기'가 '동물로 부터, 생물로 부터 얻어지는'이라는 의미가 퇴색되
었다. 따라서 최근에 유기화학은 탄소와 수소가 결합된 탄화수소를 기본으로 하는 화합물을 연구하는 학문이라고
한다. 무기화학은 탄소와 수소이외의 원소들로 이루어진 화합물 - 거의 대부분이 금속원소 - 을 연구하는 학문을
말한다.
2. 화석연료
가. 화석연료 (석탄과 석유)

▣ 유기화합물 즉 탄소화합물이 가장 많이 얻어지는 원료로는 화석연료이다. 화석연료는 옛날 생물이었던 물질로 인해
만들어진 연료인데 크게 석탄과 석유로 나뉜다.
이들이 가장 기본적인 유기화합물인 탄화수소의 주공급원으로 화석연료이다.
▣ 석탄과 석유는 지금으로 부터 3억5천만년전에서 2억 9천만년전 사이에 동식물이 무산소 상태에서 부패하여 생긴
것으로 추정되는데 석탄은 식물이 죽어서 생긴 것이로 고체상태로 생산되어 강철 생산이나 화력발전소에서 전기를
생산하는데 사용되는데 석탄 속에는 황(S)이나 유해한 환경물질이 포함되어 있어 좋은 연료라고는 할 수 없다.
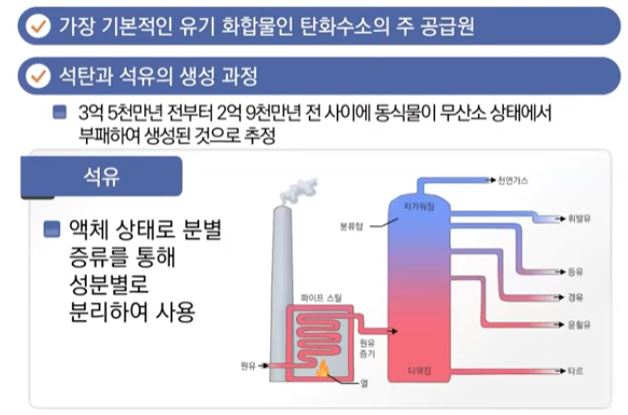
▣ 탄소화합물 중에서 중요한 원료는 석유이다. 석유는 액체상태의 원료이다. 석유는 액체 상태를 분별 증유를 통해
성분별로 분리하여 사용한다.
※ 분별증유 : 원유는 'Crude oIL), 시커먼 오일인데 이들을 파이프라인을 통해서 열을 가해 주면 그 안에 섞여 있는 가벼
운 원소는 천연가스 처럼 (탄소가 하나 아니면 둘인 물질) 가벼운 물질은 금방 증발되고 차례로 휘발유,
등유, 경유, 윤활유 순으로 증류가 되어 분리하는 것을 말한다.
▣ 우리가 사용하는 탄소화합물에는 합성섬유, 의약품 등이 있는데 이들은 기본적으로 석유에서 만들어졌다고 보면 된다.
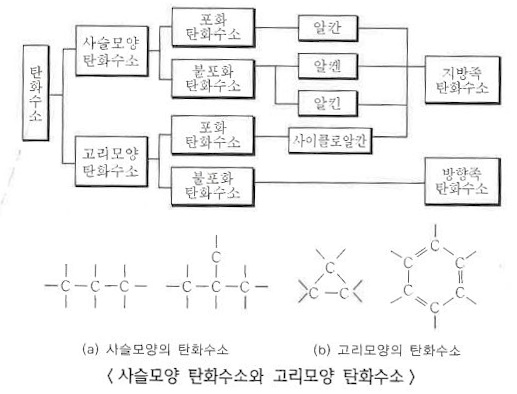
3. 탄화수소 (Hydro carbon)
가. 탄화수소의 특징
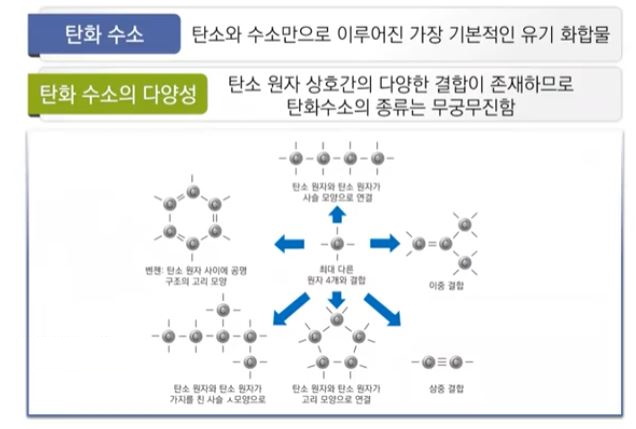
▣ 탄소와 수소로 이루어진 탄화수소는 그 종류가 무궁무진하다.
▣ 탄소와 수소의 결합은 분자 구조에서 알아 보았듯이 단일결합, 이중결합, 삼중결합 방식을 통해 다양하게 결합을
하므로 화합물의 종류가 무궁무진하다.
나. 탄화수소의 종류
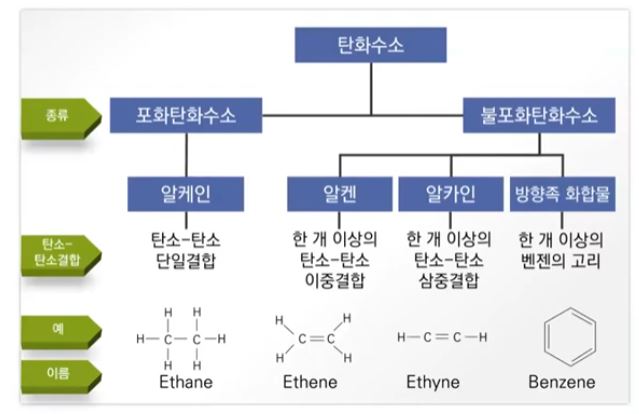
▣ 탄화수소 화합물은 포화탄화수소와 불포화 탄화수로 나뉜다. 포화탄화수소는 단일결합으로만 이루어진 화합물을
말하고 불포화탄화수소는 탄소와 탄소간 결합이 단일결합이 아니고 이중결합이 하나 있으면 알켄, 삼중결합이 하나
있으면 알카인, 이중, 단일결합 처럼 보이지만 실제로는 1.5중 결합이 6개 있는 것처럼 되어 있는 방향족 화합물이
있고 이런 고리를 '벤젠고리'라고 한다.
알케인에는 사이클로 알케인이 있는데 사이클로는 고리라는 의미가 있다. 탄소와 탄소간에 단일결합이 있지만 이들이
고리를 형성하는 것이 사이클로 알케인 화합물이다.
4. 유기화합물의 특성
가. 유기화합물의 특성
① 유기화합물의 대부분 가연성 물질이다.
② 분자간의 인력이 작아서 녹는 점과 끓는 점 (300℃ 이하)이 낮으며 물리적 · 화학적 변화의 영향도 쉽게 받는다.
③ 물에는 녹기 어려우나 알코올, 아세톤, 에테르, 벤젠 등의 유기 용매에는 잘 녹는다.
ex : 알코올, 알데하이드, 아세트산, 설탕, 포도당, 아미노산은 잘 녹는다.
④ 분자를 이루고 있는 원자 간의 결합력이 강하여 반응하기 어렵고, 반응속도가 매우 느리다.
⑤ 무기화합물 보다 구조가 복잡하며 이성질체가 많다.
⑥ 대부분 공유결합을 하고 있으므로 비전해질이다.
ex : 저급유기산 (포름산, 아세트산, 옥살산 등)은 약전해질이다.
⑦ 무기화합물의 수가 6 ~7만인데 비하여 100만 이상이나 된다.
⑧ 유기화합물의 성분 원소는 주로 C, H, O, N, P, S, 할로겐 원소 등 몇 종류 밖에 되지 않는다.
유기화합물 중에서 가장 간단한 메탄의 분자는 정사면체의 중심에 탄소 1원자와 그 정점에 수소 4원자가 위치하고
있으며, 구조식은 단지 원자의 결합선 (가표)으로 연결한 것이고, 분자의 참된 모형까지는 표시할 수 없다.
실제의 분자는 입체적인 구조이나, 구조식은 평면상에 투영된 그림에 지나지 않는다.
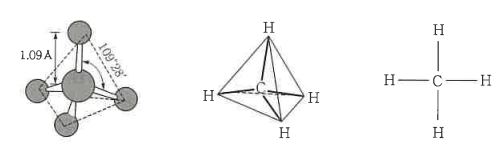
나. 구조상의 표시방법
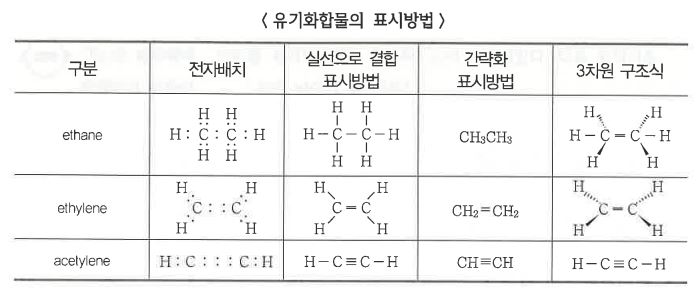
다. 이성질체
▣ 탄소 원자가 중심이 되어 여기에 수소, 산소가 결합하여 분자를 만들 경우, 탄소 골격의 배열의 차이로 인하여 같은
분자식으로 표시되어도 분자를 구성하는 원자배열이 다른 것이 생기게 된다.
이것을 이성질체라 한다.
① 메탄계 탄화수소 : CH4로 부터 C3H8 까지는 이성질체가 없고 그 이상에서는 다음과 같이 이성질체가 생긴다.
㉠ 부탄 (C4H10) : 프로판 (C3H8)의 수소원자(H) 1개 메틸기 (CH3)로 치환된 것이다.
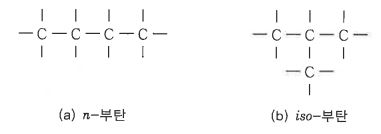
㉡ 펜탄 (C5H12) : 펜탄에는 세가지 이성질체가 있다.
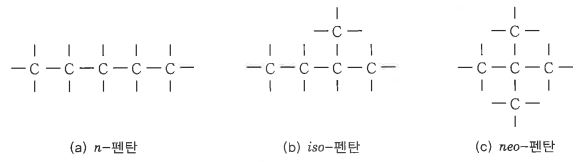
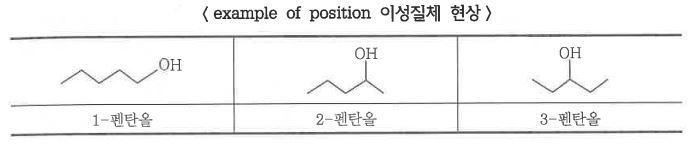
라. 위치 이성질체
▣ 위치 이성질체 현상은 사슬상의 작용기의 위치가 변화한다. 아래 표에서 Hydroxy기는 n-펜탄 사슬상의 3가지 다른
위치를 차지하여 3가지 서로 다른 화합물이 형성될 수 있다.
마. 분자골격에 따른 분류
① 사슬 화합물

② 탄소고리화합물
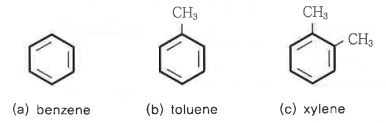
③ 헤테로 고리 화합물 : 탄소 이외의 원자, 즉 헤테로 원자를 적어도 1개 이상 가지고 있다.
ex : O, N, S 등
바. 구조식 약식화
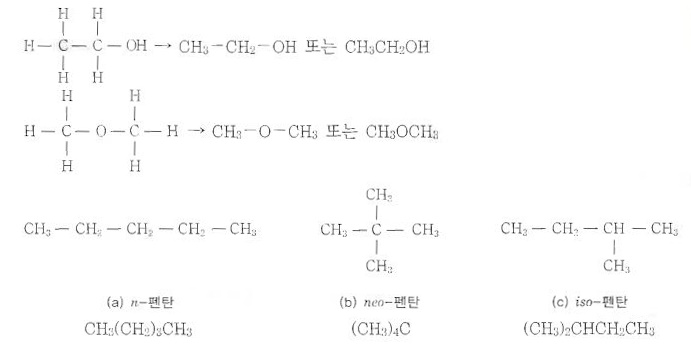
▣ 구조식을 완전히 줄여서 쓴다면 탄소 골격만을 나타내서 쓸 수 있다.
5. 유기화합물의 분류
가. 결합형태에 따른 분류
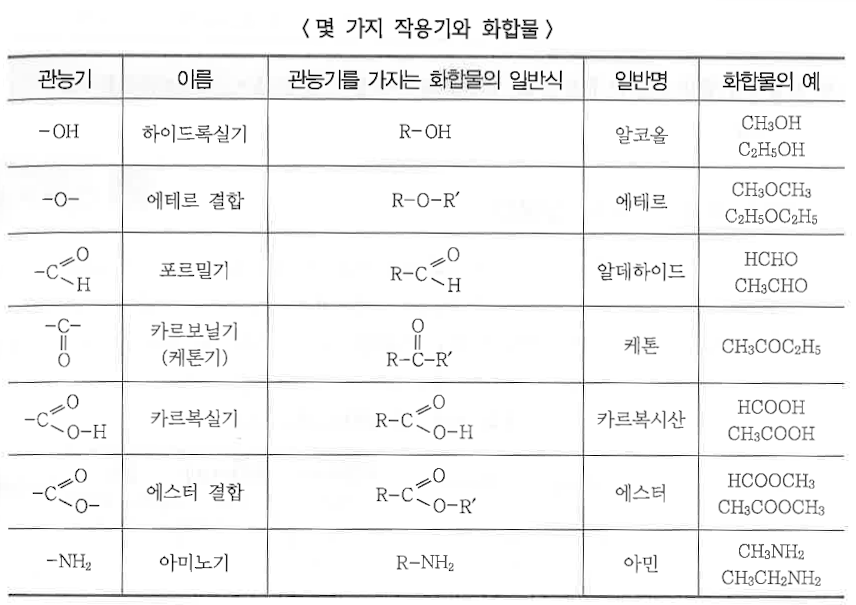
나. 작용기에 의한 분류
▣ 화합물을 구성하는 원소나 이온 중에서 그 물질의 특성을 결정하는 원자단을 유기화합물에 있어서 치환기 또는 작용기
라 하며, 이 작용기에 따라 유기화합물의 특성이나 명명법이 뚜렷이 구별된다.
<주요 알킬기>
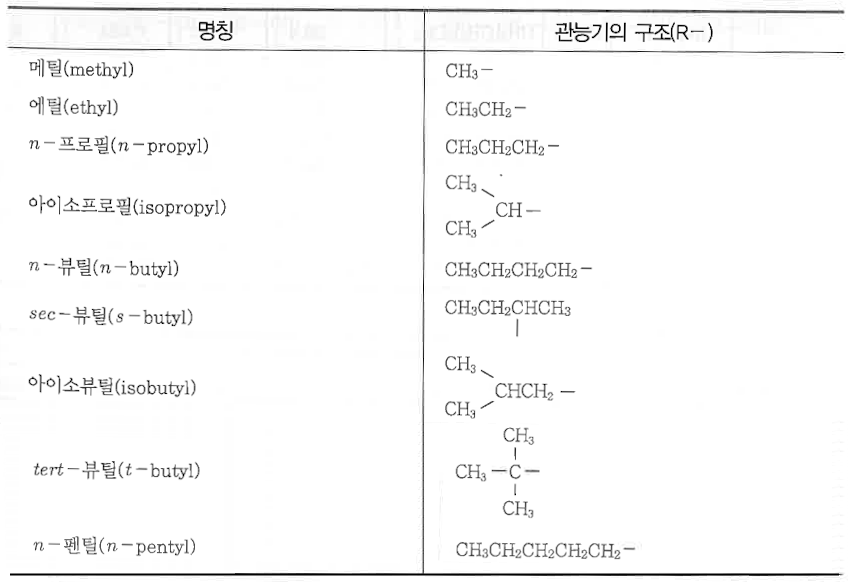
#유기화합물 #이성질체 #탄화수소 #메탄계 #펜탄 #헤테르 #작용기 #메틸 #에틸 #하이드록실기
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 유기화합물 - 방향족 및 지방족 화합물 (0) | 2024.11.20 |
|---|---|
| 유기화합물 - 알칸, 알켄, 알킨 (10) | 2024.11.19 |
| 무기화합물 (0) | 2024.11.18 |
| 산화 · 환원 반응 (화학반응) (6) | 2024.11.17 |
| 용액과 용해도 (0) | 2024.11.13 |