1. 방향족 화합물
가. 벤젠
▣ 벤젠 구조의 표현방법은 공명구조이론에 의한 것이다.
벤젠에는 2종류의 기여구조 (寄與構造)가 있고 그것들이 공명혼성체 (resonance hybrid)로 된다.
따라서 Kekule의 구조식은 그 한쪽만을 나타내고 있고 실제의 구조식은 π 전자가 6개의 탄소 사이에
비편재화 (delocalization)된 π결합으로 되어 있는데 보통 다음과 같은 구조식을 사용한다.
▣ 즉, 6개의 수소원자는 등가 (等價)이고 6개의 탄소 - 탄소 원자간의 거리도 각각 1.40 A 이며, σ 결합의 거리 1.54 A과
π결합의 1.33 A의 거의 중간치이다.
이 구조를 통하여 1, 2 dichlorobenzene이 1개 종류 밖에 존재하지 않는 이유도 이해된다.

나. 방향족 화합물의 명명법
① 치환벤젠의 명명법 : 벤젠의 6개의 탄소원자가 등가이어서 1 치환 벤젠에서는 그 치환위치를 나타낼 필요가 없고 치환
기의 명칭 뒤엔 'qpswps ( - benzene)'을 붙이면 된다.

또한, 방향족 탄화수소에는 많은 관용명이 사용되고 있으며, 그 예는 다음과 같다.

▣ 관용명으로 불리는 2치환 벤젠의 예는 다음과 같다.
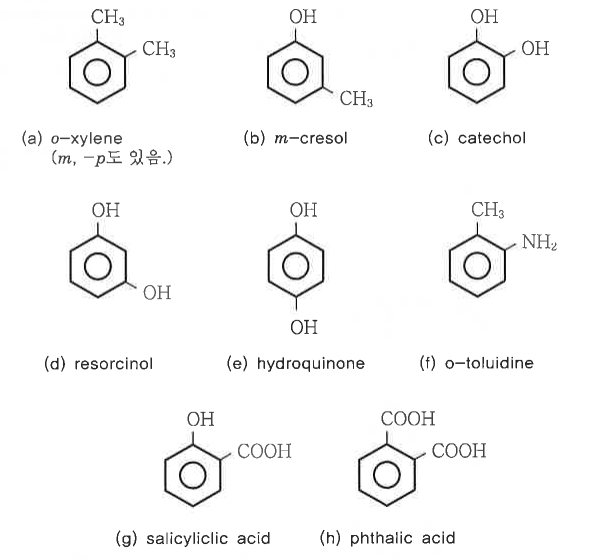
다. 다치환 벤젠의 명명법
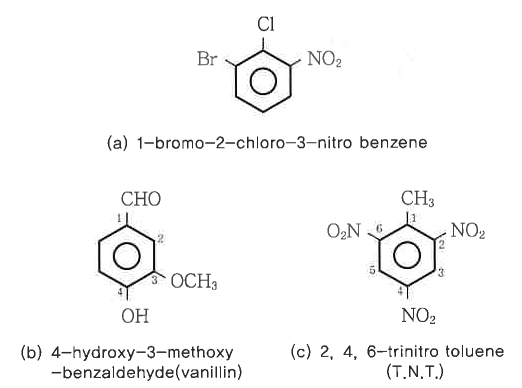
<벤젠형 방향족 화합물 및 그 성질>

2. 지방족 탄화수소의 유도체
가. 알코올류 (R-OH)
① 알코올의 분류

② 주요 알코올

③ 알코올의 일반성
㉮ 저급일수록 물에 잘 녹으며 고급 알코올은 친유성을 띤다.
㉠ 분자량이 작은 것을 저급, 분자량이 큰 것을 고급이라 한다.
㉡ R - OH 중 R은 친유성을, - OH 는 친수성을 띠고 있으며 R이 작으면 - OH의 친수성이 강해서 물에 잘 녹고,
R이 크면 친유성이 강해지고 상대적으로 친수성은 작아져 물에 잘 녹지 않는다.
㉯ 저급 알코올이 물에 이온화되지 않아 중성을 띤다.
㉰ 알칼리 금속과 반응하여 수소 기체가 발생한다.
2R - OH + 2Na → 2R - ONa + H2
※ 알칼리 금속과 반응하여 수소를 발생시키는 물질
◈ 알킬기에 - OH가 붙어 있는 물질은 모두 반응하며, NaOH과 같은 염기와는 반응하지 않는다.
( - OH 검출 반응)
ex : H - OH, R - OH, R - CO · OH, -OH, -CO · OH 등
㉱ 극성을 띠고 있으며, 강한 수소 결합을 하여 분자량이 비슷한 알칸족 탄화수소 보다 끓는 점이 높다.
㉲ 산화반응을 잘한다.
㉳ 에테르와 이성질체 관계에 있다.
④ 알코올의 산화반응
㉮ 1차 알코올 산화
▣ 1차 알코올을 1번 산화시키면 알데하이드, 다시 산화시키면 카르복시산이 된다.

㉯ 2차 알코올의 산화
▣ 2차 알코올 산화시키면 케톤이 된다.

나. 에테르류 (R - O - R')
▣ 산소원자에 2개의 알킬기가 결합된 화합물이다.
디메틸에테르 [CH3OCH3 (b.p. -23.7℃]와 디에틸에테르 [C2H5OC2H5 (b.p. 34.6℃]의 두가지가 있다.
① 제법 : 알코올에 진한 황산을 넣고 가열한다.

② 일반적 성질
㉮ 물에 난용성인 휘발성 액체이며, 인화성 및 마취성이 있다.
㉯ 기름 등 유기물을 잘 녹인다. (유기 용매)
㉰ 수소원자를 알킬기로 치환한다.
ex : (C2H5)2O [에틸에테르]
C2H5OCH3 [에틸메틸에테르]
▣ 보통 사용하고 있는 에테르는 디에틸에테르로서 단지 에테르라고 부르기도 한다.
③ 용도 : 용매, 마취제로 사용된다.
예제 : 다음 중 에테르의 일반식은 어느 것인가 ?
① R - O - R ② R - CHO ③ R - COOH ④ R - CO - R
[풀이] R - O - R (C2H5OC2H5) 답 : ①
다. 알데하이드류 (R - CHO)
▣ 알데하이드는 일반적으로 R - CHO로 표시되고 (R은 알킬기) 원자단 - CHO를 알데하이드기라고 한다.
① 알데하이드기 (-CHO)는 산화되어서 카르복실기로 되는 경향이 강하므로 일반적으로 강한 환원성을 가지고 있다.
이 경우에 알데하이드는 카르복시산으로 된다.
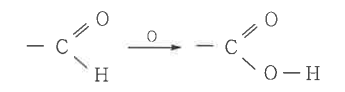
② 펠링 용액을 환원하여 산화 제1구리의 붉은 침전 (Cu2O)을 만들거나 암모니아성 질산은 용액을 환원하여 은을 유리
시켜 은거울 반응을 한다. 알데하이드 검출에 이용한다.
라. 케톤 (R - CO - R')
▣ 일반적으로 R - CO - R'로 표시되는 (R, R'은 알킬기)물질을 케톤이라 한다. 케톤은 카르보닐기 (>C=O)를 가진 두개의
알킬기로 연결된 화합물을 말한다. 양쪽에 모두 알킬기로 결합한 카르보닐기를 케톤기라 한다.
ex : 디메틸케톤 : CH3COCH3, 에틸메틸케톤 : C2H5COCH3, 아세톤 : CH3-CO-CH3
마. 카르복시산류 (R - COOH)
① 일반적 성질
㉮ 유기산이라고도 하며, 유기물 분자 내에 카르복실기 (-COOH)를 갖는 화합물을 말한다.
㉯ 알데하이드 (R-CHO)를 산화시키면 카르복시산 (R-COOH)이 된다.
㉰ 물에 녹아 약산성을 띤다.
ex : CH3COOH + H2O = CH3COO- + H3O+
㉱ 수소결합을 하므로 비등점이 높다.
㉲ 알코올 (R - OH)과 반응하여 에스터 (R - O - R')가 생성된다.

㉳ 염기와 중화반응을 한다.
ex : RCOOH + NaOH → RCOONa + H2O
㉴ 알칼리 금속 (K, Na 등)과 반응하여 수소 (H2)를 발생시킨다.
ex : 2R - COOH + 2Na → 2RCOONa + H2

② 용도 : 저급 알코올의 초산 에틸은 좋은 향기를 가지므로 과실 에센스로 사용되며 용매로도 사용된다.
ex : 초산에틸 (CH3COOC2H5) : 딸기 냄새
초산아밀 (CH3COOC5H11) : 배 냄새
낙산에틸 (C3H7COOC2H5) : 파인애플 냄새
#벤젠 #공명혼성체 #방향족 #치환벤젠 #알코올류 #알킬기 #에테르 #알칼리금속 #알데하이드 #케톤
#카르복시산 #에스터
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 유체역학 기초 이론 (단위와 차원) (4) | 2024.11.22 |
|---|---|
| 반응속도와 화학평형 (4) | 2024.11.21 |
| 유기화합물 - 알칸, 알켄, 알킨 (10) | 2024.11.19 |
| 유기화합물 - 1 (4) | 2024.11.18 |
| 무기화합물 (0) | 2024.11.18 |
