【 목 차 】
1. 전기 에너지와 화학적 변화
2. 전해 전지와 전기 분해
3. 전기 분해의 공업적 이용
4. 페러데이의 전기 분해 법칙
1. 전기에너지와 화학적 변화

▣ 배터리를 다시 충전하는 것은 외부에서 전기에너지를 주어 충전하게 되는 것이다.
핸드폰을 사용하여 방전된 경우에 콘센트에 꽃아 다시 충전하는 경우에 충전은 물이
전기분해되는 과정이다. 물에 전기에너지를 가해 줘서 수소와 산소 기체로 분리하는
과정이다. 물을 전기 분해 하려면 전기를 물에 효과적으로 전류를 흘려 줘야 하므로
물에 이온을 용해시켜서 전극 사이에 전하가 통할 수 있도록 해 줘야 한다. 광석에서
알루미늄 금속을 환원하는 것도 전기분해하는 과정의 일종이다.
(알루미늄은 지각에서 제일 많은 금속이지만 1850~60년대에 와서야 사람들이 이용
하기 시작했고 본격적으로 이용하게 된 것은 1900년대에 들어 와서이다)
▣ 알루미늄은 반응성이 좋아서 Al2O3라는 산소와 결합한 상태로 있는데 이 화합물에서
산소를 떼어내는 것이 알루미늄이 반응성이 좋아 어렵다. 이 물질을 용광로에 넣어 봤자
용광로 온도가 1000[℃]ㅇ서 1500[℃] 사이인데 알루미늄이 녹는 점이 있고 해서
알루미늄은 용광로에서 1500[℃] 짜리 돌이 돼서 나오게 된다. 그래서 알루미늄 금속이
되는 것도 전기에너지를 이용하는 것이다.
2. 전기에너지와 전기분해
가. 전해 전지
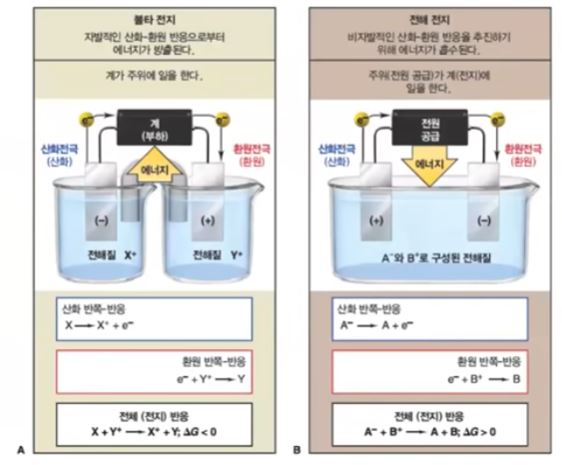
▣ 위 그림의 왼쪽 부분은 앞에서 배운 볼타전지를 나타낸 것이다. 오른쪽은 전해전지를
나타낸 것이다. 볼타 전지는 자발적인 산화 · 환원 반응을 이용한 것이다. 볼타 전지는
아연판이 구리 처럼 반응성이 다른 금속이온을 이용하여 왼쪽 즉 anode는 산화반응
이니까 아연판이 전자를 내놓고 따라서 anode는 마이너스(-) 역할을 하고 그 내놓은
전자들을 오른 쪽에 있는 Cathode 즉, 구리용액에 있는 구리 이온이 받아서 구리로
석출되게 된다. 아연판은 점점 작아지고 구리는 점점 커지게 된다. 그런데 여기서 점점
아연(Zn)이 녹아 들어가니까 플러스(+) 이온이 너무 많아 지니까 가운데 염다리에서
마이너스(-) 들이 공급되어야 하고 오른쪽에는 플러스가 가서 너무 석출되다 보니 염
다리에서 플러스(+)가 공급돼야 되는 이런 형태로 전기를 흐르게 하는 형태였다.
▣ 오른 쪽 그림의 전해전지는 볼타 전지와 정반대의 반응을 하게 된다. 그런데 이 반응은
비자발적 반응으로 반응이 일어나게 하기 위해서 에너지 즉, 전기에너지를 공급하는 것이다.
▣ 따라서 외부의 전원에 연결된 것이다. 외부 전원에서 외부 전원장치의 플러스(+)극과
연결된 선 즉 플러스 극과 연결된 전극에서 (외부 전원이 플러스(+)라는 것은 전자를
빼앗아 가고 있다는 것을 의미한다) 전자를 잃어 버리는 일이 발생한다. 그래서 산화
전극 즉 anode가 되는데 이 anode를 보면 이 전해 전지에서 자발적인 산화 · 환원
반응은 아니다. 전자를 자발적으로 내 놓는 것이 아니고 외부 전원의 플러스(+)극과
연결되어 있기 때문에 전자를 빼앗기는 것이다. 따라는 anode를 외부 전극, 외부 전원
의 전하와 부호를 같게 잡는다. 그래서 전원이 플러스이고 외부 전원의 마이너스(-)와
붙어 있으므로 전자가 공급되는 곳이고 여를 마이너스(-) 부호를 쓰고 음극 Cathode
가 된다. 따라서 볼타전지와 전해전지의 가장 큰 차이는 볼타전지는 anode가 마이너스
(-)인데 전해전지는 anode가 플러스(+)가 된다. 하지만 둘 다 산화반응이 일어나는
곳이다. 볼타전지는 자발적으로 산화반응이 일어난다면 전해전지는 자발적이라기 보다
는 어떠한 과정 즉 외부의 전원의 플러스(+)에 붙어 있어서 전자를 빼앗기니까 또는
외부의 전원의 마이너스(-)와 연결되어서 전자를 주니까 어쩔 수 없이 반응이 진행되는
그런 과정이다. 볼타 전지는 자발성, 전해전지는 비자발성이 가장 중요한 개념이 된다.
나. 화학전지와 전해전지(전기분해)의 전극 비교
▣ 화학전지는 anode가 왼쪽에 써지고 산화전극이 된다. 우리말로 양극이다. Cathode는
환원반응이 일어나는 곳이고 우리말로 음극이다.
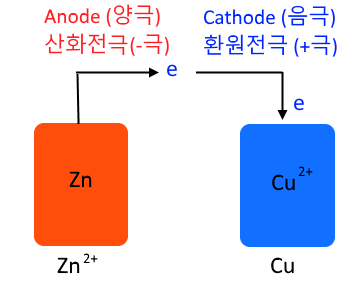
▣ 이온이 구리용액에 와서 붙는 것이니까 전자가 Cathode 극 쪽으로 들어 오게 된다.
화학전지는 금속의 반응성이 큰 원소가 anode가 되고 반응성이 작은 금속원소가
Cathode가 된다.
▣ 전기분해가 되는 전해전지는 상황이 변하게 된다. 전해전지의 전기분해에서는 어떤 금
속이든 상관없다. 2개의 금속을 외부 전원에 연결하면 되기 때문이다.

▣ 이렇게 외부 전원의 플러스(+), 마이너스(-)를 연결하게 된다. 외부 전원과 같은 극성을
갖게 된다. 비자발적인 반응이기 때문이다. 따라서 플러스(+)극은 외부 전원의 플러스
(+)와 연결되어 외부 전원에 플러스는 전자를 받아 들이는 곳이다. 따라서 플러스(+)극
은 전자를 빼앗기는 곳이 된다. 여기서도 산화극이니까 Anode이고 양극이지만 극성은
플러스(+)가 된다. 전해전지는 자발적인 반응을 하는 것이 아니기 때문이다.
▣ 외부전지의 마이너스(-)극과 연결된 Cathode는 환원전극이고 우리말로 음극이라 부른다.
외부 전원 마이너스(-)와 연결되었으니 이 극에서 전자를 공급한다.
Anode가 산화극이고 Cathode가 환원극인 것은 화학전지와 전해전지가 같은데 차이
가 있다면 화학전지에서는 anode의 부호가 마이너스(-)인데 전해전지는 부화가 (+)인
것이 차이가 난다.
다. 용융 염화소듐 vs 염화소듐 수용액의 전기분해, 그리고 물의 전기분해시 사용할 수 있는 이온들

▣ 용융 염화소듐은 화학식을 NaCl(I)로 쓴다. 염화소듐 수용액은 NaCl(aq)로 쓴다. 그리고
물의 전기분해시 사용할 수 있는 이온들에 대하여 알아 보자. 한쪽 플라스크에는
NaCl 용융액이 들어 있다. 이곳에는 Na+와 Cl- 이온 밖에 없다. 그런데 NaCl 용융액이
있는 곳에 외부 전원을 연결해 주면 +극의 네모판 전극에서는 전자를 빼앗아 가게 되므로
Na+와 Cl- 중에 전자를 누군가는 빼앗기게 되는데 Na+는 전자가 없어 Cl-가 전자를
빼앗기게 된다. 따라서 Anode 극에서 일어나는 반응은 2Cl-가 Cl2와 2e 전자로 바뀌게
되는 반응이 일어난다. 이 반응의 결과로 Anode극에서는 염소기체 (Cl2)가 발생
하게 되고 염소기체(Cl2)가 날아 가는 모습을 볼 수 있게 된다. 이 때 마이너스(-)과 연
결된 즉, Cathode와 연결된 전극에서는 이 극에서는 전자 e를 계속하여 공급하여 주게
되므로 원래 나트륨(Na)은 전자를 안 받으려고 하는 성향을 가지고 있지만 (전자를 버
리는 성향이 3번째이니까 전자를 잘 버리는 금속임), 전자를 잘 안 받으려고 하지만
용융액이다 보니 Na+와 Cl- 밖에 2종류 이온 밖에 없다. Cl2는 이미 기체가 되어 날아
갔고 Na+ 밖에 전자를 받을 원소가 없게 되므로 할 수 없이 Na+가 전자를 받아서 Na
가 된다. 그런데 이 용융액에 전자 1[mol]이 들어가면 Cl2 는 분자하나당 전자가 2개
필요하게 된다. 그러므로 전자 1[mo]을 공급하게 되면 Cl2는 0.5[mol]이 발생하게
되고 Na는 원자 하나당 전자 하나가 필요하므로 1[mol]의 Na가 발생하게 된다.
▣ 그런데 NaCl 수용액이 되면 상황이 조금 달라지게 된다. NaCl 수용액에는 Na+, Cl-,
H2O가 있게 된다. 플라스크 안에 Na+와 Cl- 그리고 물(H2O)가 있게 된다. 그리고 외부
전원에 연결된 전기분해 전극을 설치하게 되면 플러스(+) 극 anode 극에서는 전자를
빼앗고 싶은데 마이너스(-)를 띤 Cl-가 전자를 빼앗길 수 밖에 없게 된다. 그런데 수용
액에는 물도 있다. 물의 이온 O2-가 있다. 전자를 빼앗기는 것은 전기음성도를 비교해
야 하는데 Cl 보다는 O가 전기음성도가 크다. 따라서 산소(O)는 전자를 빼앗기지 않
게 된다. 따라서 실제 일어 나는 반응은 H2O가 있긴 하지만 산소(O)가 염소 (Cl) 보다
전자를 갖으려는 힘이 크기 때문에 염소(Cl2)가 기체가 되어 날아 가게 되고 염소(Cl-)
가 전자를 빼앗기게 된다. 또한 전자를 계속하여 공급하는 마이너스(-), Cathode극
에서는 이 극에서 전자를 계속하여 공급하게 되면 전자를 받을 수 있는 물질은 Na+가
있고 물도 있게 된다. 그런데 금속의 이온화 경향은 K, Ca, Na... 순으로 나트륨(Na)
이 3번째이다. 금속의 이온화 정도는 K - Ca - Na - Ma - Al - Zn - Fe - Ni - Sn - Pb -
(H) - Cu - Hg - Pt - Au 순인데 여기서 주석(Sn), 수소(H), 구리(Cu) 순으로 나타나
는데 따라서 나트륨(Na) 보다 물에 있는 수소(H)와 물은 수소(H+)와 (O2-)가 결합한
물질이므로 나트륨은 전자를 더 잘 받을 수 있는 수소(H+)가 있으므로 전자를 받지
않고 수소가 전자를 받아 H2 기체가 되어 날아가 버리고 OH- 2개가 생긴다. 따라서
마이너스 극에서는 환원반응이 일어 나는데 Na+는 아무 것도 반응이 일어나지 않고
수용액이니까 물이 환원되어서 수소(H2)기체가 발생하고 OH-가 발생하게 된다.
이렇게 하여 물(H2O)가 Cathode 극주변에서 반응하여 OH-가 생겼고 마이너스(-)
극이니까 Na+가 마이너스(-) 근처로 가게 되고 마이너스(-)극 근처에서 플러스(-)가
모이게 되므로 Na+와 물의 전기분해로 생긴 OH-가 만나서 수산화나트륨(NaOH)가
생긴다. 이 과정이 NaCl 수용액이 전기분해 되는 과정을 나타낸 것이다. 이 경우 NaCl
수용액에 전자 1[mol]을 넣은 경우 염소는 분자 하나당 전자가 2개 필요한데 전자
1[mol]을 넣으면 염소는 0.5[mol]이 발생하고 수소는 분자 1개당 전자가 2개 필요하
므로 수소 기체 0.5[mole]이 발생하게 된다. 또 전자 2개가 들어가면 OH-도 2개가
발생하게 되므로 OH-는 전자 하나당 하나가 생긴다. Na+는 Cathode 극에 모여 들
기만 할 것이고 따라서 전자 1[mol]이 주어지면 NaOH도 1[mole]이 생기게 된다.
그리고 순수한 물은 전기를 못 흘린다고 했다. 순수한 물은 이온이 너무 적어서 H+와
OH- 모두 10 -7 밖에 없기 때문에 전기가 전류를 형성하지 못한다. 따라서 물의 전기
분해시 사용할 수 있는 이온들을 보면 염소(Cl)와 같은 원소가 들어 가면 안된다.
왜냐하면 물 대신에 Cl2가 전자를 잃고 염소(Cl2)가스가 나오니까 물에서 산소가 나오
게 할 수 없게 된다.
▣ 따라서 물의 전기분해시 사용할 수 있는 플러스(+) 이온은 K+, Ca2+, Na+, Mg2+,
Al3+ 으로 반응성이 좋은 금속들이다.
마이너스(-)으로 쓸 수 있는 물질들은 NO3-, F-, SO42-, CO32-, PO43- 등으로 음이온
자체가 안정된 물질들이다. 하지만 이때 플러스 이온과 마이너스 이온을 연결하는
과정에서 만약 Ca 와 SO4를 연결한다면 문제가 된다. 이들은 +2, -2 이온으로 구성되
어 있어 물에 안 녹는데 황산칼륨이 석고인데 그럼 전기 분해시 사용할 수 있는 이온인데
물에 녹지 않는다. 따라서 플러스(+) 이온과 마이너스(-) 이온을 따로 구분하여 알고 있
되, 플러스(-)이온과 마이너스(-) 이온을 연결하여 전기전류가 잘 흐르게 하려면 칼륨과
황산을 연결하면 괜찮다. 물에 잘 녹는다. 따라서 용해도 규칙과 연결하여 생각해야 한다.
▣ 이상에서 설명한 내용을 그림으로 요약하면 다음과 같다.
라. 용융염화 소듐의 전기분해

마. 염화소듐 수용액의 전기분해

바. 물의 전기분해

3. 전기분해의 공업적 이용
가. 소듐의 제조 : 용융 염화 소듐의 전기 분해
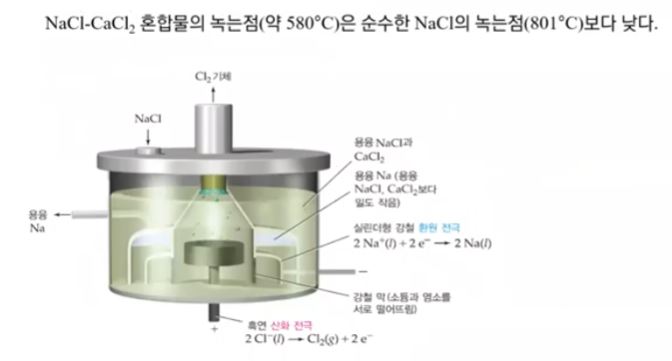
▣ 염화나트륨(NaCl)과 염화칼슘(CaCl2)의 혼합물 중에 순수한 소금(Na)은 801[℃]에서
녹는데 이들 물질을 혼합시키면 약 580[℃]에서 녹는다. 왜 그런지 아직 밝혀지지는 않
했지만 산화알루미늄 전기분해에서 알루미늄을 얻을 때도 마찬가지로 산화알루미늄은
약 3,000[℃]가 되어야 녹는다. 그 산화알루미늄을 빙정석 등과 섞으면 약 1,000[℃]
에서 녹는다. 아직 정확한 메커니즘은 밝혀지지 않았다. 이들 혼합물은 녹는 점이 훨씬
낮으므로 특정 혼합물을 넣어서 NaCl과 염화칼슘 혼합물을 만들어서 산화 · 환원 반응
을 시켜 용융 염화 소듐에서 나트륨도 찾아 내고 Cl2도 얻는다.
나. 염소와 수산화 소듐의 제조 : 염화소듐 수용액의 전기분해

다. 알루미늄 생산
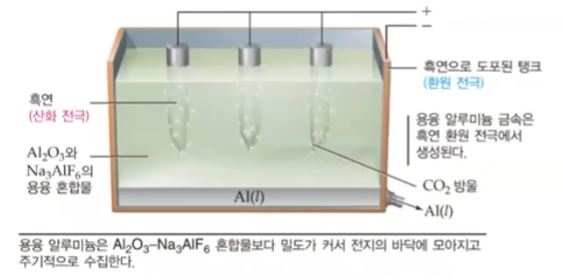
▣ 산화 알루미늄은 거의 3,000[℃]가 되어야 녹는데 이에 빙정석 등을 섞으면 약 1,000
[℃]에서 녹는다. 흑연으로 된 플러스(+)극에서 산화 알루미늄은 Al3+ 와 O2-가 있는데
플러스(+)극에서는 산소가 전자를 빼앗기고 O2 기체가 된다. Al3+ 는 여기 바깥에 흑연
으로 도포된 환원 전극에서 표면에서 Al3+ 가 전자를 받아서 알루미늄이 액체로 떨어진다.
산소기체는 온도가 매우 뜨겁다. 온도가 거의 1,000[℃]가 되는데 흑연과 산소 그러
니까 탄소와 산소가 만나면서 온도가 1,000[℃]이다. 그러면 화학반응이 일어 나서 이
산화탄소 (CO2)가 기체가 생성된다. 이렇게 이산화탄소(CO2)가 생기게 되므로 흑연은
소모되어 이 알루미늄을 생산할 때 흑연 전극은 계속 교체해 줘야 한다. 또한 이산화탄소
(CO2)는 지구온난화의 주범이다. 이 때 나오는 이산화탄소를 드라이아이스를 만든다
든지 이산화탄소 기체를 산업에 이용한다.
라. 전해 정제 (= 제련)
▣ 전기분해를 이용해 순수한 금속으로 정제하는 과정
[구리의 제련]

▣ 구리는 전기를 흐르게 하는 전선에 사용하는데 불순물이 조금만 있어도 전기가 흐르는데
저항이 커져서 전선이 끊어질 수도 있다. 따라서 구리는 순도가 99.99[%] 정도가 되어
야 전선으로 사용할 수 있다. 순도가 99[%]라면 일반적인 금속이라면 순도가 높은 편인
데 전선으로 사용하는 구리는 순도가 99.99[%] 이상이 되도록 해야 한다.
▣ 이러한 고순도의 구리를 얻기 위해 위 그림과 같이 순도 99[%] 구리와 순도 99.99[%]
구리 금속을 구리 용액이 있는 곳에 담그고 외부 전극에 플러스(+)와 마이너스 (-)를 연
결해 준다. 플러스(+)에 연결된 전극은 anode라서 산화가 일어나는 곳이다. anode는
산화극으로 양극이라 부른다. 순도 99[%] 구리는 불순한 구리이다. 불순한 구리는
전자를 빼앗기므로 구리이온(Cu2+) 가 되어 나오기도 하며 이곳에 포함된 1[%]의 불순
물은 대게 철(Fe), 니첼(Ni) 등이 있다. 은이나 금, 백금 등이 들어 있기도 한다. 만약
백금(Pt)이 들어 있다고 하면 구리는 전자를 빼앗겨서 구리이온 (Cu2+) 이온이 되는데
백금은 (Pt)는 반응성이 안좋아 전자를 빼앗기지 않는다. 불순물을 둘러싸고 있는 구리
는 이온(Cu2+) 이 되어 녹게 되는데 불순물은 그 물질 그대로 밑으로 침전되게 된다.
따라서 은, 금, 백금 처럼 구리보다 반응성이 낮은 금속들은 작은 금속들이 되어 침전된
다. 이렇게 양극 찌거기들은 쌓이게 되고 마이너스(-) 극에서는 전자가 계속 공급된다.
그러면 이온 중에 있는 구리이온은(Cu2+) 가 마이너스(-)에 달라 붙게 된다. 철도 음극
에 달라 붙고 싶겠지만 구리보다 반응성이 낮아 전자를 받을 생각이 없다. 결국 구리
이온 (Cu2+) 들이 많아 전자를 이들이 받게 되므로 은, 금, 백금은 이온이 아닌 알갱이로
바닥에 침전된다. 따라서 Cathode극 음극의 구리는 순도가 자꾸 높아져서 99.99[%]
이상의 순도를 갖게 된다. 즉, 순수한 구리를 생산할 수 있게 된다. 이 과정이 불순한 구
리를 순수한 구리로 만드는 과정 즉 제련 전해 정제 과정이다. 그런데 공업 과정에서 구
리 1[ton]을 만드는데 소요되는 비싼 전기료인데 예전에는 정제 과정에서 생산되는
금, 은, 백금 등의 부산물로 커버를 했다고 한다. 요즘도 금, 은, 백금 등의 가격이 올라
경제성에 도움이 된다고 한다.
이 과정을 다시 정리하면 아래 그림과 같다.

4. 페러데이 (Faraday)의 전기 분해 법칙
▣ 전기분해 과정에서 석출되는 물질의 양은 다음에 의존한다.

예제) 용융 CaCl2에 0.5[A]의 전류를 1시간 통과시켰을 때 석출되는 Ca의 질량을 구하시오. (Ca 40.078 [g/mol])

▣ 전자 1 [mol] = 1[F] = 96,485 [C] , 1[C] = 1 [A] × 1 [sec]
▣ 0.5 [A] × 3600[s] = 1800 [C]
1800 [C] ÷ 96,485 = ? [mol] 전자 몰 수
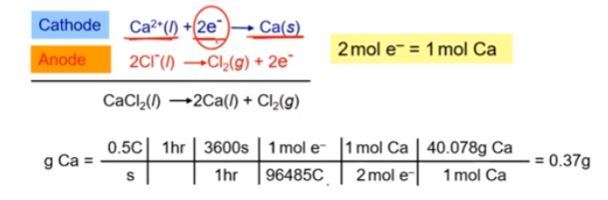
▣ 이렇게 전류와 시간을 알면 전기화학 반응식에서 나오는 물질의 양을 구할 수 있는 것
이 페러데이의 전기분해 법칙이다.
[페러데이 전기분해 법칙 적용과정]

예제) 30.0[A]의 일정한 전류가 NaCl 수용액에 1.00[h] 동안 흘렀다. 몇 [g]의 NaOH와
몇 [ℓ]의 Cl2 기체가 STP에서 생성되는지 계산하시오.
30 [A] × 3600 [s] = C ÷ 96,485 = 전자 몰수
[풀이]
▣ 환원 전극에서 생성된 NaOH의 질량은 다음과 같이 계산할 수 있다.

'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 건축 방재 - 소방학 개론 (4) | 2022.12.21 |
|---|---|
| 피난 - 소방학 개론 (0) | 2022.12.20 |
| 전기화학과 화학전지 - 기초 화학 (2) | 2022.12.16 |
| 산화 · 환원 반응 - 기초 화학 (0) | 2022.12.15 |
| 엔트로피와 자유에너지 - 기초 화학 (0) | 2022.12.13 |
