1. #발화점 (Ignition point) = #착화점 = 착화온도
▣ 점화원을 가하지 않아도 스스로 착화될 수 있는 최저 온도 발화점이 낮을 수록 위험하다.
① 가연성 물질에 불꽃을 접하지 아니하였을 때 연소가 가능한 최저온도
② 공기중에서 스스로 타기 시작하는 온도
③ 점화원이 없이 가연물에 가열된 열에 의하여 스스로 연소가 시작되는 최저온도
※ 고체물질 중 발화온도가 가장 높은 물질 : 인견
※ 발화점, 인화점, 폭발범위는 아무런 연관성이 없다.
※ 식용류는 발화점이 450[℃] 정도된다. 후라이팬에 달구어 놓고 식용류를 뿌리면 불이 붙는다.
발화점은 가연물이 스스로 불이 붙는 온도를 말한다.
※ 황린은 제3류 위험물이다. 발화점이 34[℃]이다. 일반적인 위험물 중에서 발화점이 가장 낮은 물질이다.
황린은 고체이다. 일반적으로 기온은 공기의 온도인데 고체는 햇볕을 받으면 쉽게 기온이 상승한다.
기온이 낮더라도 발화점에 도달할 수 있다.
※ 발화점에 영향을 주는 인자
㉠ 가연성 가스와 공기의 혼합비 ㉡ 공간의 형태와 크기
㉢ 가열속도와 지속시간 ㉣ 기벽의 구조와 촉매효과
㉤ 점화원의 종류와 에너지 수열 방법
※ 발화점이 낮아질 수 있는 조건
㉠ 산소와의 친화력이 클수록 ㉡ 압력이 높을 수록
㉢ 탄소수가 많을 수록 (인화점과 발화점은 반대방향으로 움직인다. )
⊙ 탄소수가 많으면
◈ 발화점이 낮다. ◈ 발열량이 크다. ◈ 분자구조가 복잡하다. ◈ 증기압이 낮다. ◈ 분자량이 크다.
※ 발화점 가솔린 300℃, 등유 220℃ 경유 200℃
2. #인화점 (Flash point)
▣ 가연성 기체와 공기가 혼합된 상태에서 외부의 직접적인 점화원에 의해 불이 붙을 수 있는 최저 온도, 인화점이
낮을 수록 위험성이 크다. 그러므로 인화점 아래에서는 불씨, 불꽃 등을 가하여도 연소현상이 진행되지 않는다.
① 휘발성 물질에 불꽃을 접하여 연소가 가능한 최저 온도
② 가연성 증기 발생시 연소범위의 하한계에 이르는 최저온도
③ 가연성 증기를 발생하는 액체가 공기와 혼합하여 기상부에 다른 불꽃이 닿았을 때 연소가 일어나는 최저 온도
④ 액체 가연물의 화재 위험성 기준의 척도
⑤ 가연성 액체의 발화와 깊은 관계가 있다.
⑥ 연료의 조성, 점도, 비중에 따라 달라진다.
◈ 점화원에 의해 불이 붙을 수 있는 최저 온도
⊙ 탄소수가 적은 물질 < 탄소수가 많은 물질
∴ 탄소수가 적을 수록 인화의 위험이 크다.
⊙ 인화점은 최저온도 이므로 보통의 경우 인화점에서는 인화되지 않는다.
※ 가솔린 인화점 : -43[℃] ~ -20[℃], 연소범위 1.4 ~ 9.6 [%]
등유 인화점 : 50 ~ 60 [℃]
벤젠 인화점 : - 11 [℃]
※ 물질의 #인화점 및 #착화점
|
물 질
|
인화점 [℃]
|
착화점 [℃]
|
|
프로필렌
|
- 107
|
497
|
|
에틸에테르, 디에틸에테르
|
- 45
|
180
|
|
가솔린 (휘발유)
|
- 43
|
300
|
|
산화프로필렌
|
- 37
|
465
|
|
이황화탄소
|
- 30
|
100
|
|
아세틸렌
|
- 18
|
335
|
|
아세톤
|
- 18
|
560
|
|
벤젠
|
- 11
|
562
|
|
메틸에틸케톤
|
- 9
|
404
|
|
톨루엔
|
4.4
|
480
|
|
메틸알코올
|
11
|
464
|
|
에틸알코올
|
13
|
423
|
|
아세트산
|
40
|
-
|
|
등유
|
43 ~ 72
|
210
|
|
경유
|
50 ~ 70
|
200
|
|
적린
|
-
|
260
|
3. #연소점 (Fire point)
▣ 연소상태를 5초 이상 유지하기 위한 최저 온도로 인화점보다 10[℃] 정도 높다.
① 인화점 보다 5 ~ 10 [℃] 높으며 연소를 5초 이상 지속할 수 있는 온도
② 어떤 인화성 액체가 공기 중에서 열을 받아 점화원의 존재하에 지속적인 연소를 일으 킬 수 있는 온도
③ 가연성 액체에 점화원을 가져 가서 인화된 후 점화원을 제거하여도 가연물에 계속 연소되는 최저 온도
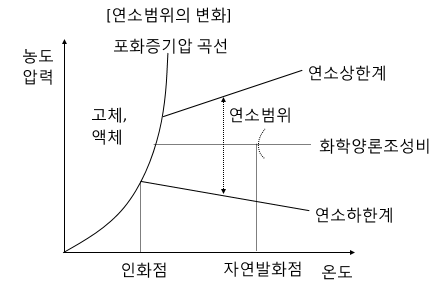
【 연소범위(연소한계 】 = 폭발범위 (폭발한계)
▣ 1기압, 25[℃] 공기중에서 측정
▣ 연소가 가능한 폭발성 혼합가스 (가연성 기체 + 공기) 중 가연성 기체의 체적 %
▣ 하한값이 낮을 수록, 범위가 넓을 수록 위험하다.
▣ 주변의 변화에 따라 연소범위는 변화한다.
<연소범위의 변화>
㉠ 온도가 높아지면 넓어진다.
㉡ 압력이 높아지면 넓어진다. (수소와 일산화탄소는 좁아진다)
㉢ 공기중의 산소의 농도가 높아지면 넓어진다.
㉣ 불활성기체를 투입하면 연소범위는 좁아진다.
4. 위험도
▣ 위험도는 폭발범위를 활용하여 가연물의 연소위험성을 가름할 수 있는 계산값으로 위험도가 클수록 가연물의
연소 위험성이 커진다.
◈ 아세틸렌 (C2H2)의 연소범위 : 2.5 ~ 81 [%]
* 지구상에서 아세틸렌이 폭발범위가 가장 넓다.
◈ 이산황화탄소 (CS2)의 연소범위 : 1.2 ~ 44 [%]
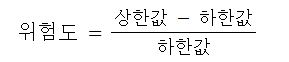
※지구상에서 가장 위험도가 큰 물질
5. 비중 (Specific gravity)
▣ 물 4 [℃]를 기준으로 했을 때의 물체의 무게 (고체, 액체)
※ 기체 : 표준상태 0 [℃], 1기압 공기의 비중 1
프로판, 부탄 > 1, 메탄 < 1
6. 비점 (Boiling point), 끓는 점, 비등점
▣ 액체가 끓으면서 증발이 일어날 때의 온도
※ 적은 양의 액체가 기체로 되는 것을 증발이라고 하고 대량으로 되는 것을 비등, 끓는다고 한다.
▣ 어떤 물질의 증기압이 대기압과 같아질 때의 온도를 #비점 · 비등점이라고 한다.
▣ 비등점은 물질의 물리적인 특성값으로 고유의 값을 갖는다.
▣ 물의 비점이 100[℃] 인 것은 주변압력이 대기압일 때이며 주변압력이 다를 경우 비점은 달라 진다.
▣ 비등점이 낮은 가연물은 증기압이 커서 기체가 되기 쉬우므로 화재위험이 크다고 볼 수 있다.
7. 비열 (Specific heat)
▣ #비열 이란 어떤 물질의 단위 질량을 1[℃] 높이는데 필요한 열량이다.
⊙ 가연물에 비열이 크면 온도 상승이 어려워 화재 위험성이 감소한다. 또한 비열이 큰 소화액제는 소화효과가 크다.
(에너지 흡수가 크다)
⊙ 비열 : [kcal / kg · ℃], [cal / g · ℃]
◈ 물 : 1 [cal / g · ℃] , 수증기 : 0.44 [cal / g · ℃] , 얼음 : 0.5 [cal / g · ℃] , 사안화탄소 0.2 [cal / g · ℃]
① 1 [cal] : 1 [g]의 물을 1 [℃] 만큼 온도를 상승시키는데 필요한 열량
② 1 [BTU] : 1 [lb]의 물을 1 [°F] 만큼 온도 상승시키는데 필요한 열량
③ 1 [chu] : 1 [lb]의 물을 1 [℃] 만큼 온도 상승시키는데 필요한 열량
※ 1 파운드 [lb] = 0.452592 [kg]
※ 1 [kcal] = 4.184 [kJ], 1[cal] = 4.184 [J]
※ 열용량은 어떤 물질을 1[℃] 높이는데 필요한 열량을 말하며 단위는 [kcal/℃]이다.
#열용량 = 비열 × 무게 [㎏]
8. #융점 (Melting point)
▣ 대기압 하에서 고체가 용융하여 액체가 되는 온도
9. #용해도
▣ 용해도란 용매 100[g]에 녹을 수 있는 용질의 [g] 수를 말한다.
▣ 고체, 액체, 기체의 용해도가 있다.
① 기체의 용해도는 기체가 액체가 되는 것을 말한다.
⊙ 액체 → (고온, 저압) → 기체 * 이상 기체 상태로 되는 것
기체 → (저온, 고압) → 액체 * 응축한다고 한다.
② 액체의 용해도는 용매와 섞이는 것을 말한다.
⊙ 액체의 용해도는 온도, 압력과는 무관하다.
⊙ 액체는 극성이 같을 때 용해가 일어난다.
③ 고체의 용해도는 압력에는 무관하고 온도에 비례한다.
※ 소금(NaCl)의 용해도는 온도와 무관하다.
10. 잠열 (Latent heat)
※ latent [ leɪtnt ] 잠재하는, 잠복해 있는 latent disease 잠복중인 병
▣ 잠열이란 온도의 변화없이 상태 변화에 필요한 열량
▣ 어떤 물질이 고체, 액체, 기체로 상태를 변화하기 위해 필요로 하는 열
◈ 고체 → 액체 (융해잠열) : 얼음 0[℃] → 물 0[℃] : 80 [kcal/kg]
◈ 액체 → 기체 (기화잠열) : 물 100[℃] → 수증기 100[℃] : 539 [kcal/kg]
※ 잠열 Q = kcal / kg × kg = kcal
【 물의 #잠열 】
|
① 80 [cal / g] : 융해 잠열
② 539 [cal / g] : 기화(증발) 잠열
③ 639 [cal] : 0 [℃]의 물 1 [g]이 100 [℃]의 수증기로 되는데 필요한 열량
④ 719 [cal] : 0 [℃]의 얼음 1 [g]이 100 [℃]의 수증기로 되는데 필요한 열량
|
[ex] -5[℃]의 얼음 10 [kg]을 150[℃]의 수증기로 만들기 위해 필요한 열량은 몇 [kcal] 인가 ?
<풀이> 0.5×10×5 + 80×10 +10×100 + 10×539 + 0.44×50×10 = 7,435 [kcal]
11. #현열 : 감열
▣ 상태의 변화없이 물질의 온도변화에 필요한 열
◈ -5 [℃]의 얼음 → - 2 [℃]의 얼음
◈ 20 [℃]의 물 → 50 [℃] 의 물
◈ 100 [℃]의 수증기 → 150 [℃]의 수증기
※ 현열 Q = kcal / kg·℃ × kg = kcal
12. #점도 (Viscosity)
▣ 액체의 점착과 응집력의 효과로 인한 흐름에 대한 저항을 측정하는 기준
※ 점도가 크다는 것은 탄소수가 많다는 것으로 쉽게 연소하지 않는다.
점도가 큰 물질은 화재안전도 면에서 좋다.
13. 증기압 (Vaper pressure) = #대기압
가. 정의
① 어떤 물질이 일정한 온도에서 열평형 상태가 되는 증기의 압력
② 증기가 액체와 평형상태에 있을 때 증기가 새어 나가려는 압력
나. 증기압의 특성
① 기압계에 수은을 이용하는 것이 적합한 이유는 증기압이 낮기 때문
② 쉽게 증발하는 휘발성 액체는 증기압이 높다.
③ #증기압 은 밀폐된 용기 내의 액체 표면을 탈출하는 증기의 양이 액체 속으로 재 침투하는 증기의 양과 같은 때의
압력
④ 유동하는 액체 내부에서 압력이 증기압 보다 낮아지면 액체가 기화하는 공동현상 (cavitation) 발생
⑤ 증기분자의 질량이 작을 수록 큰 증기압이 나타난다.
⑥ 분자운동이 커지면 증기압이 증가한다.
⑦ 액체의 온도가 상승하면 증기압이 증가한다.
⑧ 증발과 응축이 평형상태일 때의 압력을 포화증기압이라 한다.
⑨ 증기압의 단위
atm, ㎜Hg, kg/㎠, mH2O, mAq, PSI, lb/in2, kPa, N/㎠, mbar
14. 증기비중 (Vaper Specfic Gravity)
【 비중 (Specific Gravity)】

▣ 공기분자량 (29 [g])에 대한 가스 #분자량 의 비
⊙ 화재의 위험성을 판단하는 매우 중요한 요소이다.
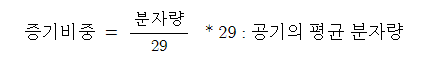
【 밀도 (Density)】

⊙ 물의 밀도 : 1 [㎏/ℓ]
⊙ 수은의 밀도 : 13.6 [㎏/ℓ]
② 표준상태 기체의 밀도 (0[℃], 1기압)인 경우
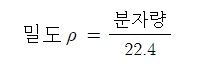
15. #아보가드로 의 법칙
▣ 표준상태 (0[℃], 1기압)에서 모든 기체 1 [mol (1kmol)] 이 차지하는 부피는 22.4 [ℓ (㎥)] 이다.
⊙ mol → g → ℓ
⊙ kmol → ㎏ → ㎥
▣ 1 [mol]의 질량 = 분자량 [g]
▣ 1 [kmol]의 질량 = 분자량 [㎏]
▣ 표준상태가 아닌 기체의 밀도
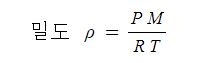
ρ : 밀도 [㎏/㎥], P : 압력 [N/㎡], M : 분자량 [㎏/kmol], K : 절대온도 [K], R : 기체상수 [N·m/kmol,K]
16. 증기 - 공기 밀도 (Vaper-Air Density)
▣ 어떤 온도에서 액체와 평형상태에 있는 증기와 공기의 혼합가스의 밀도이다.
⊙ 증기- 공기 밀도가 1보다 크면 공기보다 무거우므로 대기중에서는 낮은 곳에 표류하여 인화될 위험이 증대된다.
※ 기체 액체 #평형 상태
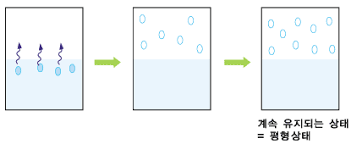

17. 증기 #밀도 (Vaper Density)
▣ 액체나 고체에서 발생된 증기가 일정한 체적에서 차지하는 증기의 #질량

'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 화재 - 소방학 개론 (0) | 2023.04.12 |
|---|---|
| 기체에 관한 법칙 (연소론) (0) | 2023.04.11 |
| 화재 (자연발화) - 화재론 (2) | 2023.04.09 |
| 산소공급원 - 연소론 (0) | 2023.04.09 |
| 점화원 (인화점, 발화점, 연소점) (2) | 2023.04.09 |