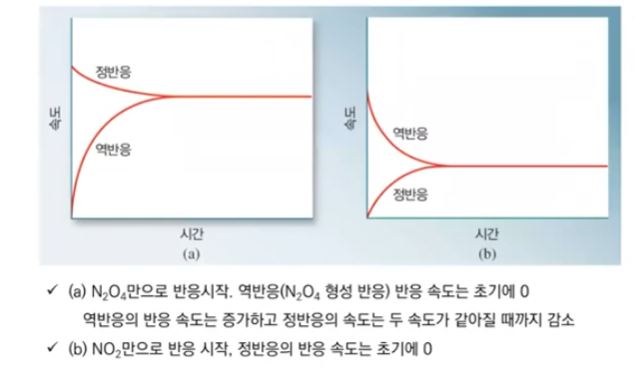
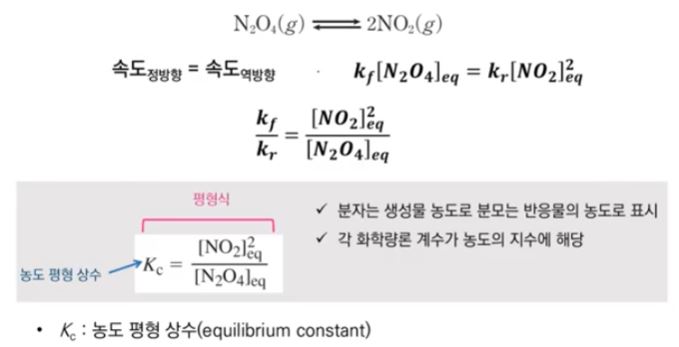
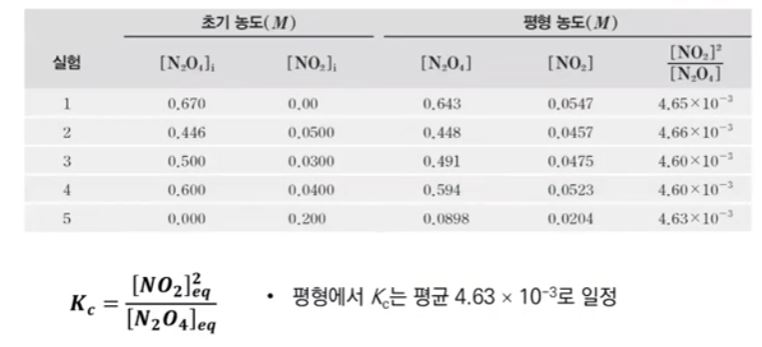
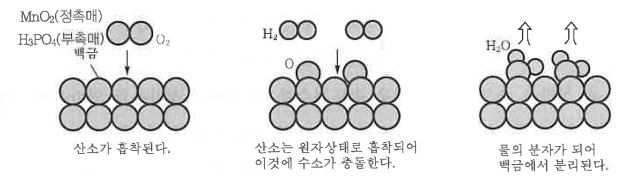
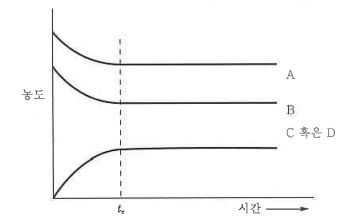
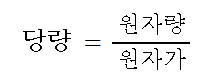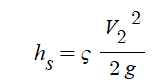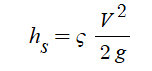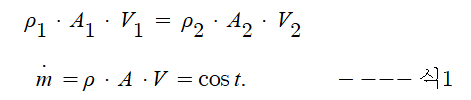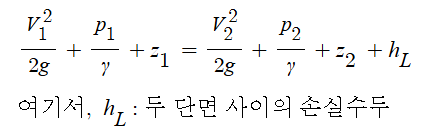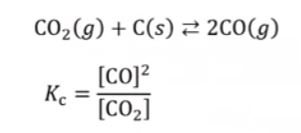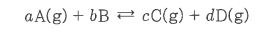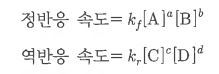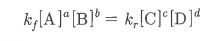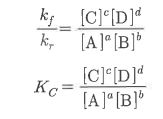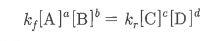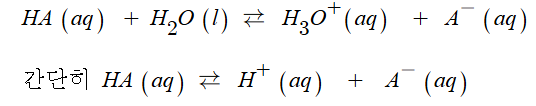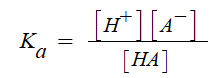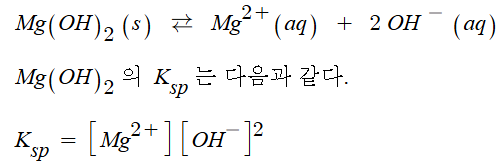화학에서 아주 중요한 개념인 '몰농도'에 대해 알아 봅시다.
몰농도란 무엇일까요 ?
몰농도는 용액 1리터 속에 들어있는 용질의 몰 수를 나타내는 것입니다.
쉽게 말하면, 물 같은 용매에 얼마나 많은 양의 물질이 녹아 있는지를 나타내는 것입니다.
몰농도의 단위는 M(몰라, molar)이죠.
예를 들어, 1M 설탕물은 물 1리터(ℓ)에 설탕 1몰(mol)이 녹아 있는 것을 나타냅니다.
몰농도를 구하는 공식은 이렇습니다.
몰농도 (M) = 용질의 몰(mol) 수 / 용액의 부피 (ℓ)

이제 몰농도(M)에 대해 더 자세히 알아봅시다.
1. 몰농도의 의미
▣ 몰농도는 용액의 진하기를 나타내는 방법 중 하나입니다.
진하다는 것은 용질이 많이 녹아 있다는 뜻이고,
묽다는 건 용질이 적게 녹아 있다는 뜻입니다.
2. 몰농도의 예시
▣ 0.1M 소금물 : 물 1리터에 소금 0.1몰이 녹아 있는 수용액의 농도를 말합니다.
▣ 2M 설탕물 : 물 1리터에 설탕 2몰이 녹아 있는 수용액을 말합니다.
3. 몰농도 계산하기
▣ 예를 들면, 물 500 ㎖에 소금 29.25 g을 녹였다고 한다면
소금의 분자량이 58.5g / mol이라면 몰농도는 어떻게 될까요?
▣ 풀이
① 먼저 소금의 몰 수를 구합니다.
29.25g ÷ 58.5 g /mol = 0.5mol
② 용액의 부피를 리터(ℓ)로 바꿉니다.
500 ㎖ = 0.5 ℓ
③ 몰농도 산정 공식에 대입합니다.
몰농도 = 몰수 / 부피(ℓ) = 0.5 mol / 0.5 ℓ = 1 M
따라서 이 소금물의 몰농도는 1M 입니다.

4. 몰농도의 활용
▣ 몰농도는 화학 실험에서 정말 많이 사용됩니다.
예를 들어, 산과 염기의 반응을 연구할 때나 약품을 만들 때
몰농도를 이용해 정확한 양을 계산합니다.
5. 몰농도와 일상생활
▣ 우리 일상생활에서도 몰농도 개념을 찾아볼 수 있죠.
예를 들어, 주스를 물로 묽게 만들 때도 비슷한 원리를 사용합니다.
이제 몰농도를 응용하여 삼투압 몰농도에 대해 알아 봅시다.
삼투압 몰농도란 무엇일까요?
삼투압 몰농도는 용액의 삼투압을 나타내는 방법입니다.
삼투압은 반투막을 사이에 두고 물이 이동하도록 하는 힘(압력)을 말합니다.
삼투압 몰농도의 단위는 Osm(오스몰, osmole) 입니다.
삼투압 몰농도를 구하는 공식은 아래와 같습니다.
삼투압 몰농도 (Osm) = i × 몰농도 (M)
여기서 i는 반트호프 계수라고 하고 이는 이온화 정도에 따라 달라집니다.

삼투압 몰농도의 예를 들어 봅시다.
◈ 0.9% 생리식염수 : 혈액과 같은 삼투압을 가져서 우리 몸에 주사할 수 있어요.
◈ 5% 포도당 용액 : 수액으로 많이 사용되는 용액이에요.
삼투압 몰농도 계산하기
예를 들어,
0.1 M NaCl 용액의 삼투압 몰농도를 구해봅시다.
이때 NaCl의 반트호프 계수는 2라고 합시다.
풀이 :
삼투압 몰농도 (Osm) = i × 몰농도 (M)
삼투압 몰농도 = 2 × 0.1M = 0.2 Osm
따라서 이 용액의 삼투압 몰농도는 0.2 Osm 입니다.
몰농도와 삼투압 몰농도는 화학뿐만 아니라 생물학, 의학에서도 아주 중요한 개념입니다.
예를 들어, 우리 몸의 세포가 적절한 삼투압을 유지하는 것이 건강에 매우 중요하기 때문입니다.
이렇게 몰농도와 삼투압 몰농도에 대해 알아보았습니다.
#몰농도 #몰랄농도 #삼투압 #농도 #삼투압몰농도
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 산화수 (Oxidation state) 계산방법 및 규칙 (0) | 2024.12.03 |
|---|---|
| 몰농도, 몰랄농도, 퍼센트 농도 구하기 (0) | 2024.12.02 |
| 당량 : 당량은 화학반응으로 결정된다. (2) | 2024.11.24 |
| 퍼센트 농도, 몰 농도, 노르말 농도 (0) | 2024.11.24 |
| 펌프 이송 설비 (0) | 2024.11.23 |
비버리님의
글이 좋았다면 응원을 보내주세요!