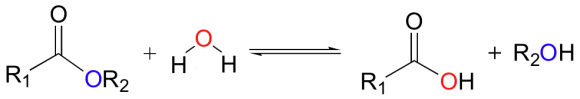
유기화합물 명명은 IUPAC 규약 및 대한화학회에서 정한 규칙에 따른다.
(대한화학회(http://www.kcsnet.or.kr)에서는 1998 년 IUPAC 화합물 이름을 우리말로 표현하는 데에 필요한 원칙을
수정 발표하였다.)
유기화합물의 명명법 : 관용명(common name), IUPAC 명
IUPAC (International Union of Pure and Applied Chemistry)
1. 알케인(Alkane)의 명명법
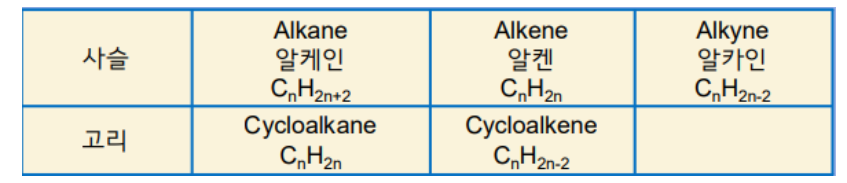
▣ 알케인: 단일결합을 가진 포화탄화수소, 파라핀(paraffin)계 탄화수소라고도 함.
▣ 일반식 : CnH2n+2 (n 은 C 의 개수)
가. IUPAC 명명법
① 포화탄화수소는 어미에 ‘-ane’을 붙여 명명한다.
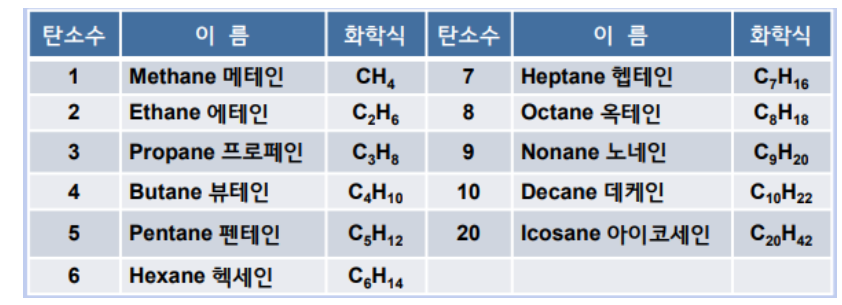
C1~C4는 methane, ethane, propane, butane 이란 관용명을 사용하고,
C5 이상은 어미에 ‘-ane’를 붙인다.
한글명은 그리스어 접두사에 접미어 “-에인”을 붙여 명명한다.
그러나 널리 사용되고 있는 methane 부터 octane 까지의 경우에는 당분간 ‘-ane’를 ‘-안’으로 적는 것 을 허용한다
(1998, 대한화학회 유기화합물명명 규칙).
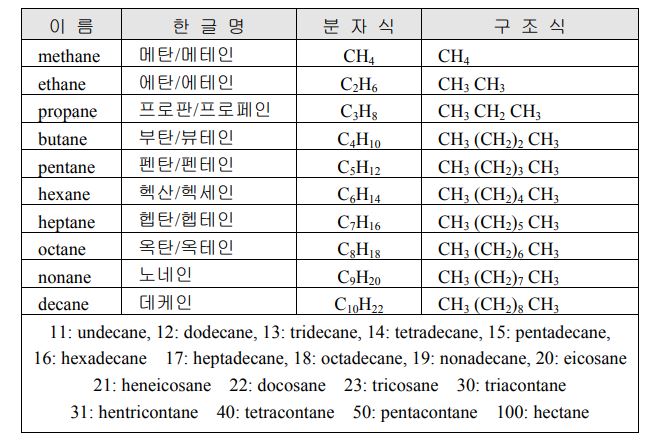
② 가지 달린 화합물은 가장 긴 사슬을 기본명으로 하고, 가지의 위치가 되도록 작은 번호가 되도록 탄소원자에 아라비아
숫자를 붙여서 결합위치-수-명칭을 기본명 앞에 붙여서 부른다.
이 때 주사슬에 붙은 집단을 치환기(substituents)라 하고, 포화탄화수소의 치환기는 알킬기(alkyl group)라 한다.
알킬기는 알케인에서 수소원자 한 개를 떼어낸 원자단으로 알케인의 이름에서 어미 ‘-ane’ 대신에 ‘-yl’을 붙여 명명
하며 R 로 표시한다.
③ 2 개 이상의 동일 치환기가 주사슬에 연결되어 있으면 다이(di-), 트라이(tri-), 테트라 (tetra-) 등의 접두어를 사용한다.
④ 숫자와 숫자사이에는 쉼표를 넣고, 숫자와 문자사이에는 hyphen(-)을 사용하며, 마지막 치환기 이름과 기본 알케인의
이름은 붙여서 쓴다.
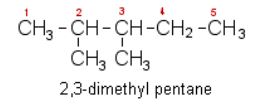
⑤ 만일 2 개 이상의 다른 종류의 치환기가 존재하면, 알파벳순으로 배열하며, 이 때 di-, tri-, -tetra 등의 접두어는 알파벳
순서를 고려하지 않는다.
그리고 치환기 이름이 알파벳 순서규칙에 우선하는 쪽에 작은 번호를 붙인다.
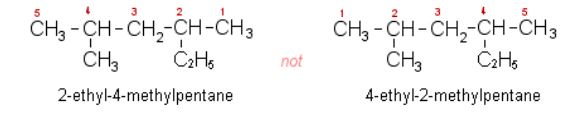
⑥ 하이픈(hyphen)으로 연결된 2차(sec-), 3차(tert-)와 같은 접두어는 알파벳 순서에 고려하지 않으나,
접두어 아이소(iso-)는 하이픈을 붙인 접두어가 아니며 알파벳 순서에 포함한다.
(문제) 다음 화합물의 IUPAC 명을 쓰시오.
2,3-dimethylhexane 2,2,4-trimethyloctane
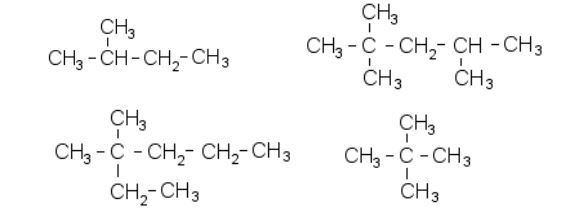
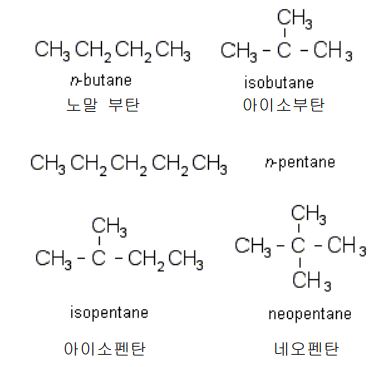
나. 관용명(Common name)
관용명은 alkane 의 이성질체를 "n-", "iso-", "neo-"의 접두사를 붙여 명명.
① n-alkane : 직선사슬 알케인
② isoalkane : 탄소의 직선사슬 끝에 methyl 기(-CH3)가 곁가지로 붙어 있는 알케인
③ neoalkane : 3 개의 methyl 기가 직선사슬에 붙어 있는 알케인
※ 알킬기(alkyl group)
알킬기 : 알케인에서 수소가 하나 제거된 원자단으로 R 로 표시
명명법 : 알케인의 이름에서 어미 ‘-에인(-ane)’ 대신에 ‘-일(-yl)’을 붙여 명명.
이때 수소원자가 1 개 모자라는 탄소원자의 번호를 '1'로 하고, 이 탄소 원자로부터 시작하는 탄소사슬 중 가장
긴 곧은 탄소사슬의 이름을 붙여서 명명.
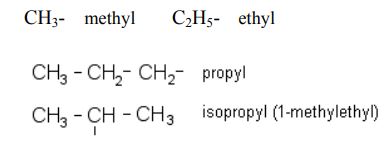
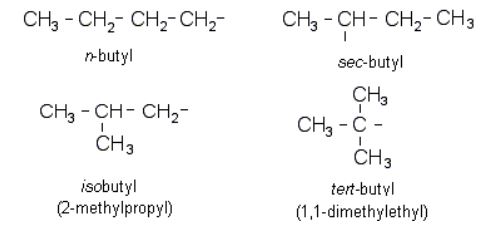
관습에 따라 가지를 가진 몇몇 알킬기 명명은 관용명을 사용한다.
2. 할로겐화 알킬(alkyl halide)
가. 할로겐화 알킬
▣ 알케인(alkane)의 수소원자를 할로겐 원자(F, Cl, Br, I)로 치환한 형태로 할로겐화 알킬(alkyl halide) 혹은 할로알케인
(haloalkane)이라 하며, 보통 RX 로 표시.
▣ IUPAC 명명법 : 탄화수소 이름에 접두어로 할로겐 이름을 치환기로 하여 명명.
할로겐 치환기는 그 원소명의 어미 “-ine”를 “-o”로 바꾸어서 haloalkane 으로 명명.
탄화수소의 탄소는 할로겐 원소 치환기에서 가장 가까운 곳에서부터 번호를 매긴다.
F (fluoro-) 플루오로 Cl (chloro-) 클로로 Br (bromo-) 브로모 I (iodo-) 아이오도
▣ 관용명 : 탄화수소의 halogen 화합물로 보고 할로겐화 알킬(alkyl halide)로 명명.
즉, RX 에서 R 기의 이름 뒤에 할로겐 원소의 어미를 “-ide”로 바꾸어서 명명
CH3Cl chloromethane (methyl chloride) CH3CH2CH2Br (1-bromopropane)
클로로 메탄 (염화 메틸) (1-브로모프로판)
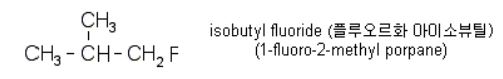
3. 사이클로알케인(cycloalkane)
▣ 사이클로알칸(cycloalkane): 고리달린 포화탄화수소 일반식은 CnH2n.
▣ 명명법 : 알칸명에 접두어 ‘사이클로(cyclo-)’를 붙여서 부른다.
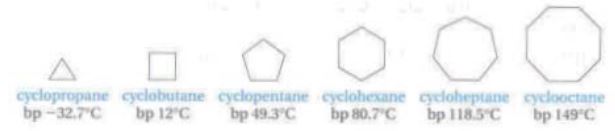
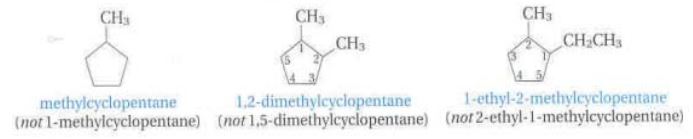
※ 치환기가 있을 경우 : alkane 의 경우와 마찬가지 방법을 따른다.
① 치환기가 있는 탄소를 1 번으로 한다 (단 치환기가 한 개인 경우 이름 앞에 1 은 생략)
② 치환기가 두 개인 경우 두 개의 치환기의 숫자가 낮은 번호가 되도록 명명한다.
③ 두 개의 다른 치환기의 경우 알파벳이 먼저 오는 것을 1 번으로 한다.
4. 알켄(alkene) 및 알카인(alkyne)의 명명법
가. 알켄(alkene)
▣ 이중결합을 가진 불포화 탄화수소
▣ 올레핀(olefin) 혹은 에틸렌계 탄화수소라고도 함.
▣ 일반식 : CnH2n
▣ 다이엔(diene) ~ 이중결합을 2 개 가진 알켄
▣ 트라이엔(triene) ~ 이중결합을 3 개 가진 알켄
나. 알카인(alkyne)
▣ 삼중결합을 가진 불포화 탄화수소로 아세틸렌계 탄화수소라고도 함.
▣ 일반식 : CnH2n-2
※ 알켄(Alkene) 및 알카인(Alkyne)의 명명법
▣ 알켄과 알카인의 명명법은 알케인과 유사하며 알케인에 상응하는 포화탄화수소의 어미를 다음과 같이 바꾸어 명명한
다.
【 IUPAC 규칙 】
① 알켄(alkene)의 명명법은 이중결합을 포함하는 가장 긴 곧은 사슬에 접미어 ‘-ene’을 붙여서 명명한다. 즉, 포화탄화수
소의 어미 ‘-에인(-ane)’을 ‘-엔(- ene)’으로 바꾸어 명명한다. 둘 이상의 이중결합이 있으면 그 위치를 번호 로 지정하고
어미에 -diene, -triene 등으로 명명한다.
② 알카인(alkyne)의 명명법은 탄화수소의 어미 ‘-에인(-ane)’을 ‘-아인(-yne)’으로 바꾸어 명명한다. 둘 이상의 삼중결합이
있으면 어미에 -diyne, -triyne 등을 사용한다.
③ 다중결합을 포함한 가장 긴 탄소 사슬을 기본명으로 하고 다중결합의 탄소 원자의 번호가 작도록 한다.
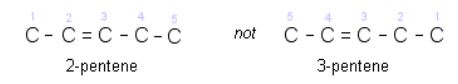
만일 다중결합이 사슬 양쪽에서 같은 거리에 있으면서 가지가 달려 있으면 가지가 달린탄소의 번호가 최소가 되도록 한다.
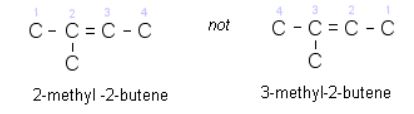
④ 2 개 이상의 다중결합이 있을 때에는 첫번째 다중결합의 탄소원자가 작은 번호가 되도록 한다.
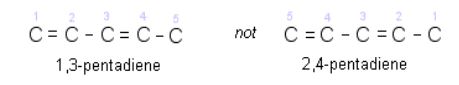
⑤ 화합물 내에 이중결합과 삼중결합을 동시에 가지고 있는 경우에는 ‘-ene-yne’ 으로 명명하고, 이때 이중결합을 가진
탄소가 작은 번호가 되도록 번호를 붙 여서 명명한다.
이중결합과 삼중결합이 사슬 끝으로 부터 같은 거리에 있으 면 이중결합에 더 낮은 번호를 부여한다.
CH2= CHCH2C ≡ CH (1-penten-4-yne, 1-펜텐-4-아인) not (1-pentyne-4-ene)
⑥ 고리 탄화수소에서는 다중결합을 가진 탄소부터 번호를 붙인다.
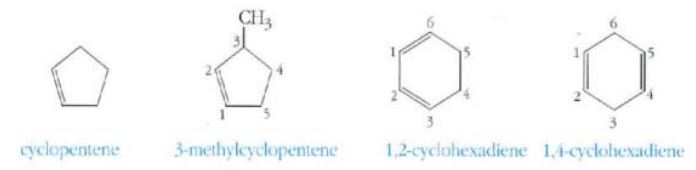
cyclopentene : 한 가지 구조만 가능하므로 번호가 필요없다.
3-methylcyclopentene : 이중결합에서 번호를 시작하되 이중결합이 포함되게 한다.
5- methylcyclopentene 이나 1-methylcyclopentene 가 아니다.
CH≡CH 의 이름 '아세틸렌(acetylene)' 은 그대로 쓴다.
【 관용명 】
에틸렌(ethylene), 프로필렌(propylene), 아세틸렌(acetylene)과 같은 몇 가지의 관용명이 쓰인다. (괄호안은 IUPAC 명)
CH2 = CH2 ethylene (ethene)
CH3CH = CH2 propylene (propene)
CH ≡ CH acetylene (ethyne)
【다중결합 원자단】
CH2 = CH - vinyl (ethenyl)
CH2 = CH-CH2 - allyl (3-propenyl)
CH ≡ C-CH2 - propagyl (3-propynyl)
5. 방향족 화합물의 명명법
▣ 방향족 화합물은 명명법이 체계화되기 이전에 널리 사용되었기 때문에 관용명과 IUPAC 명이 함께 사용되고 있다.
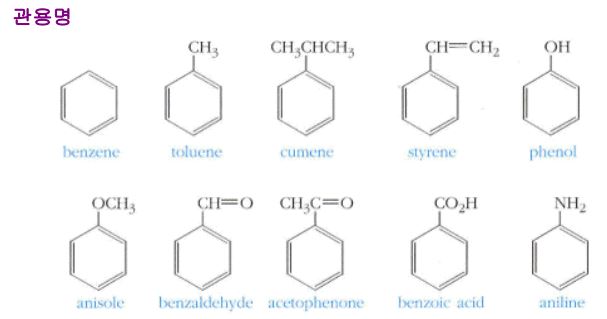
※ 벤젠의 유도체
가. 단일치환체
▣ 벤젠의 1 치환체들은 벤젠(bnezene) 앞에 치환기의 이름을 붙여서 명명.
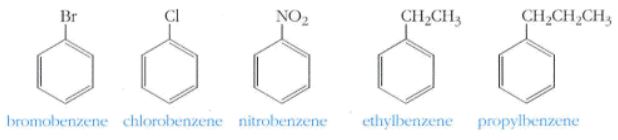
나. 2 치환체
▣ 2 치환체는 치환된 위치에 따라 오쏘(ortho-), 메타(meth-) 파라(para-)라는 접두어를 사용
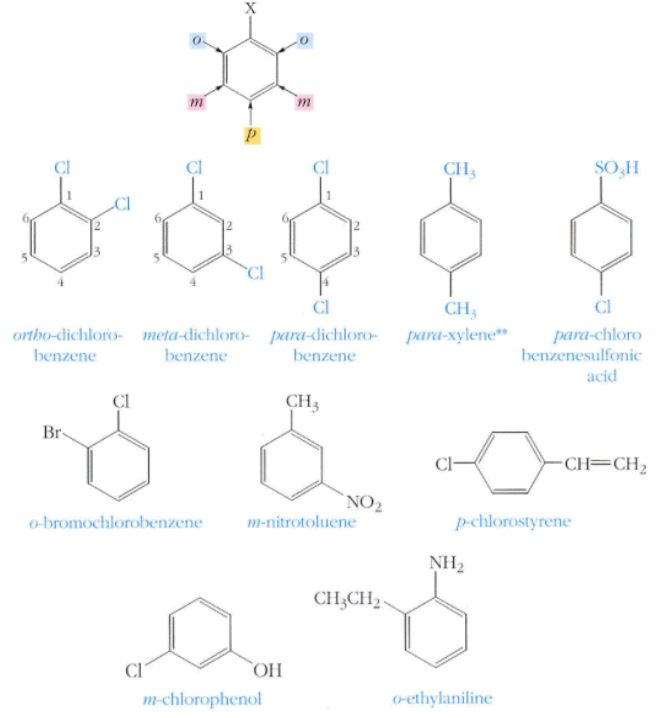
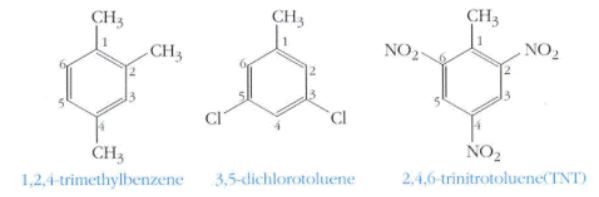
다. 3 개이상 치환기
▣ 치환기의 위치를 숫자로 표시하되 번호가 최소가 되게 하고 치환기는 알파벳 순서로 명명. 이때 관용명으로 부를 수
있는 것은 다른 치환기를 우선 명명하고 관용명을 뒤에 붙여서 명명.
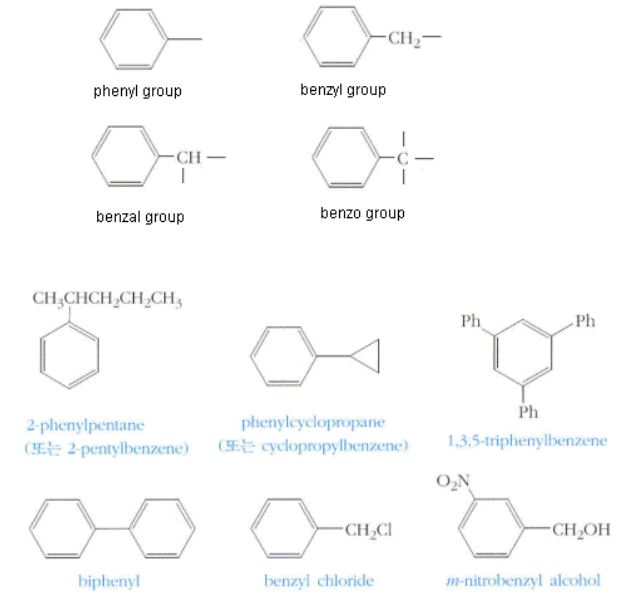
【 페닐기(phenyl group)】
▣ 방향족 탄화수소를 아렌(arene)이라 부르고, Ar 로 표시.
▣ 방향족기의 종류: 페닐기(phenyl group) Ph, 벤질기(benzyl group)
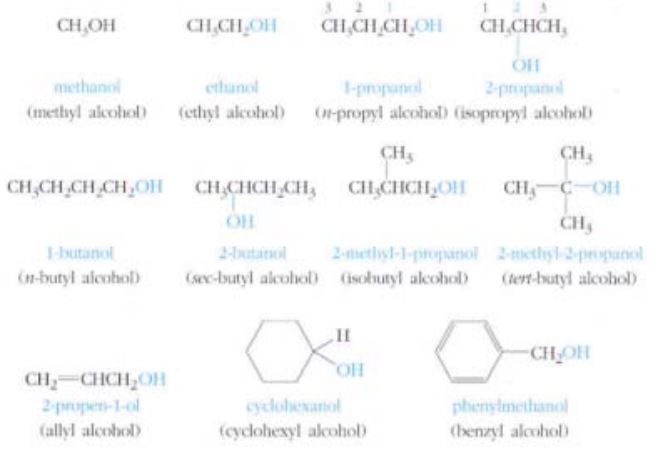
6. 알코올의 명명법
▣ 알코올(alcohol) : 물 H-OH 에서 H 한 개가 알킬기로 치환된 것
▣ 일반식 : R-OH
【 IUPAC 명】
① 하이드록시기(–OH)를 가진 제일 긴 탄소사슬을 모체로 하고, alkane, alkene, alkyne의 어미 “–e”대신 “–ol”을 붙인다.
② 탄소사슬의 번호는 –OH 기가 붙은 탄소부터 번호를 붙인다.
③ 화합물에 불포화 탄화수소 C=C, C≡C 가 있으면, 이것을 포함하는 사슬을 모체로 하여 “–ol””이라는 접미사가 이름의
끝에 오며 하이드록실기의 위치를 표시하는 숫자는 “–ol”의 앞에 놓는다.
CH2=CHCH3OH (2-propen-1-ol)
④ –OH 기가 하나 이상인 화합물은 –OH 기의 수를 ‘–ol’ 앞에 di–, tri–, tetra– 등을 붙여서 명명한다.
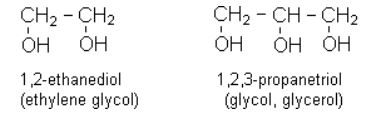
【관용명】
① 알킬기의 이름 뒤에 알코올(alcohol)을 붙인다.
② –OH 기가 2 개인 2 가 알코올은 탄화수소의 이름 뒤에 글라이콜(glycol)을 붙인다.
또는 methylene 기(-CH2)의 수를 표시하는 접두어에 methylene glycol 을 붙인다.
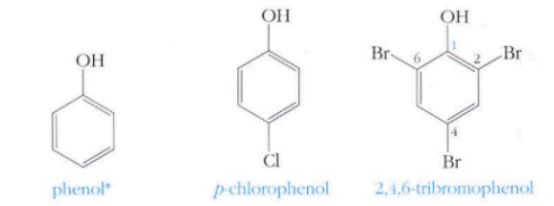
【페놀 화합물의 명명법】
▣ 페놀(phenol) : 방향족 화합물의 벤젠 고리에 –OH 가 결합된 화합물,
(‘석탄산’이라 함)
① 일반적으로 페놀 화합물의 이름은 페놀과 그 유도체의 이름을 사용하거나 관용명 으로 명명한다.
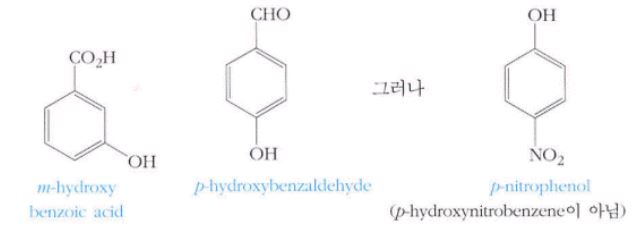
② 한 분자 내에 하이드록실기가 카복실산(RCOOH), 알데하이드(RCHO), 케톤(RCOR) 등의 작용기와 같이 있을 때는
–OH 기를 치환체로 취급하여 명명한다.
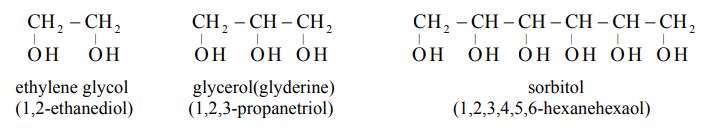
싸이올(thiol) : sulfhydryl기(-SH )를 가진 화합물,
RSH 머캅탄(mercaptan)이라고도 함.

글라이콜(glycol) : 하이드록실기(-OH) 2개가 서로 이웃한 탄소에 1 개씩 결합된 화합물.
대표적인 글라이콜로 에틸렌글라이콜(ethylene glycol)이 있고, -OH 기가 2개 이상
결합된 알코올은 글리세롤(glycerol), 솔비톨(sorbitol) 등이 있다.
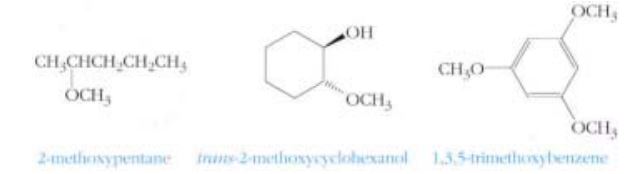
7. 에테르/에터의 명명법
▣ 에테르(ether, 에터) : 알코올 ROH 에서 H 대신 알킬기 R'로 치환된 화합물.
▣ 일반식 : R-O-R'
① 일반적으로 alkyl 기 또는 aryl 기의 이름을 알파벳 순으로 쓰고 ether 를 붙인다.

② 복잡한 에테르(에터) 화합물은 IUPAC 명을 따른다. 한 개 이상의 alkoxy 기(-OR) 가 있거나 명명 우선순위가 큰 작용기
가 있는 경우에는 alkoxy-를 치환기로 명명 한다.
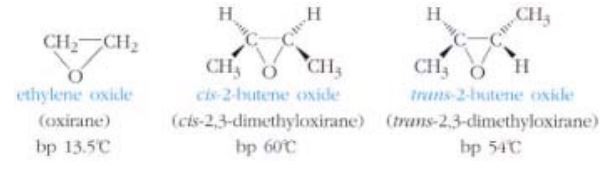
※ 에폭사이드(Epoxides)
▣ 에폭사이드는 산소원자를 포함한 3 원자 고리 에터화합물로 옥시란(oxirane)이라고도 하며, 다음과 같은 것들이 있다.
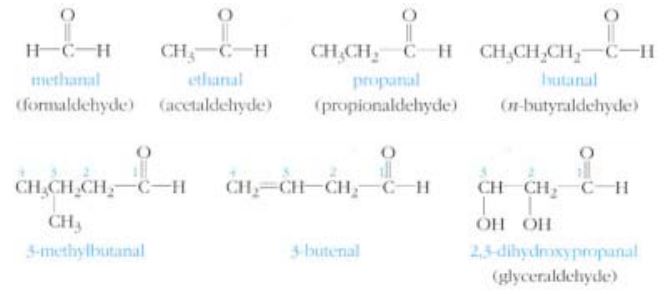
8. 알데하이드와 케톤의 명명법
▣ Aldehyde : Carbonyl기(=CO)의 탄소 원자에 1개 혹은 2개의 수소가 결합된 화합물
>C=O carbonyl group CHO– aldehyde group
▣ Ketone : 카보닐기의 탄소에 다른 탄소 2개가 결합된 화합물
RCOR aliphatic ketone RCOAr alkyl aryl ketone
ArCOAr aromatic ketone
가. 알데하이드(aldehyde)
① 관용명 : 알데하이드의 명칭은 산화하여 생성되는 산(acid)의 관용명에서 유도된다.
산의 어미 –ic 또는 –oic 대신에 aldehyde 를 붙여서 부른다.
② IUPAC 명 : Alkane 의 어미 ‘–e’를 ‘–al ’로 바꾼다. (aldehyde 의 al 을 따온 것임.)
치환기가 들어 있는 알데하이드 화합물은 -CHO 기로부터 번호를 붙여 치환기의 위치를 표시한다.
이때 -CHO 의 탄소가 1 번이 된다.
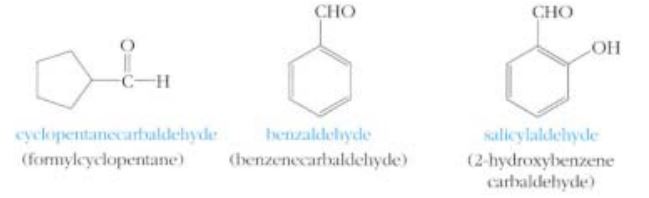
③ 고리계통의 알데하이드는 carbaldehyde 로 끝나며 방향족 알데하이드는 IUPAC 명 외에 보통 이름이 흔히 더 많이
사용된다.
나. 케톤(ketone)
① 관용명 : 카보닐기에 결합되어 있는 alkyl 또는 aryl 기의 이름 뒤에 ketone 을 붙여서 명명한다.
그러나 전통적으로 사용되던 이름은 그대로 사용하기도 한다.
② IUPAC 명 : Alkane 의 어미 ‘–e’를 ‘–one ’로 바꾼다. (ketone 의 마지막 one 을 따온 것임) 탄소사슬이 긴 케톤은 탄소에
번호를 붙이되 카보닐기의 탄소가 가장 작은 번호 가 되도록 한다.
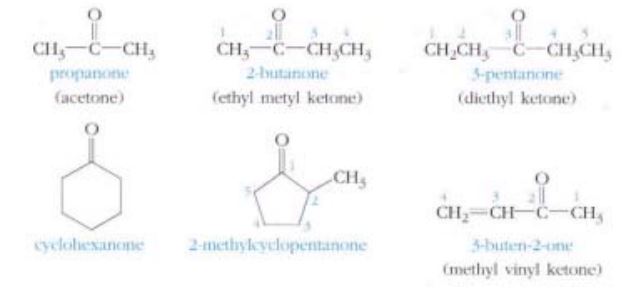
③ 몇몇 케톤은 관용명을 사용한다.
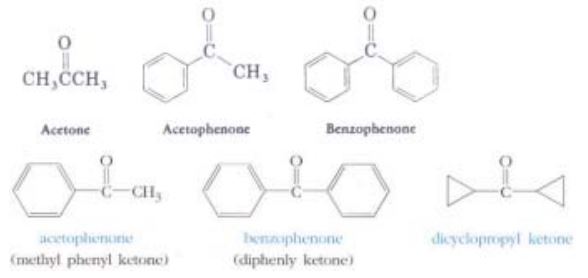
◈ –COR 기를 치환제로 취급할 경우에는 아실(acyl)기라 부른다.
–CHO : 포밀(formyl)기 –COCH3 : 아세틸(acetyl)기
–COAr : 아로일(aroyl)기
◈ 만일 다른 관능기가 있어 카보닐 산소를 치환기로 취급하여야 할 때는 옥소(oxo-)의 접두어를 사용한다. 예를 들면
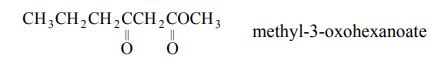
#유기화합물 #명명법 #알케인 #할로겐 #알킬 #알켄 #알카인 #방향족 #벤젠
#페닐기 #페놀 #싸이올 #글라이콜 #알코올 #알데하이드 #케톤 #에테르
#카복실산 #에스터 #아민 #아마이드
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 발열반응과 흡열반응 (0) | 2024.12.10 |
|---|---|
| 유기화합물 명명법 (Nomenclature of Organic Compounds) - 1 (0) | 2024.12.09 |
| 알킬기(alkygroup) - 탄화수소 (hydrocarbon) (0) | 2024.12.08 |
| 지방족 탄화수소(Hydrocarbon) 유도체 (0) | 2024.12.08 |
| 탄화수소 (Hydrocarbon) (0) | 2024.12.08 |