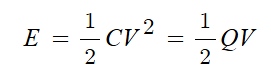1. 제2류 위험물의 종류와 지정수량
|
성질
|
위험등급
|
품명
|
대표품목
|
지정수량
|
|
가연성
고체
|
Ⅱ
|
1. 황화인
2. 적린(P)
3. 황(S)
|
P4S3, P2S5, P4Sr
|
100 ㎏
|
|
Ⅲ
|
4. 철분(Fe)
5. 금속분
6. 마그네슘 (Mg)
|
Al, Zn
|
500 ㎏
|
|
|
7. 인화성 고체
|
고형 알코올
|
1,000㎏
|
2. 공통성질, 저장 및 취급시 유의사항, 예방대책 및 소화방법
가. 공통성질
① 비교적 낮은 온도에서 착화하기 쉬운 가연성 고체로서 이연성, 속연성 물질이다.
② 연소속도가 매우 빠르고, 연소시 유독가스가 발생하며, 연소열이 크고, 연소온도가 높다.
③ 강환원제로서 비중이 1보다 크며, 대부분 물에 잘 녹지 않는다.
④ 인화성 고체를 제외하고 무기화합물이다.
⑤ 산화제와 접촉, 마찰로 인화여 착화되면 급격히 연소한다.
⑥ 철분, 마그네슘, 금속분은 물, 산과의 접촉시 발열한다.
⑦ 금속은 양성원소이므로 산소와의 결합력이 일밙거으로 크고, 이온화 경향이 큰 금속일수록 산화되기 쉽다.
나. 저장, 취급시 유의 사항
① 점화원을 멀리하고 가열을 피한다.
② 산화제와의 접촉을 피한다.
③ 용기 등의 파손으로 위험물이 누출되지 않도록 한다.
④ 금속분 (철분, 마그네슘, 금속분 등)은 물이나 산과의 접촉을 피한다.
⑤ 용기는 밀전, 밀봉하여 누설에 주의한다.
다. 예방대책
① 화기엄금, 가열엄금, 고온체와의 접촉을 피한다.
② 산화제인 제1류 위험물, 제6류 위험물 같은 물질과 혼합, 혼촉을 피한다.
③ 통풍이 잘 되는 냉암소에 보관, 저장하며, 폐기 시에는 소량씩 소각 처리한다.
라. 소화방법
① 주수에 의한 냉각 소화
② 황화인, 철분, 금속분, 마그네슘의 경우 건조사 등에 의한 질식소화
3. 위험성 시험방법
가연성 고체에 해당하는 착화의 위험성 시험방법 ㅁ치 판정기준은 다음의 규정에 따른다.
가. 착화의 위험성 시험방법 및 판정기준
① 착화의 위험성 시험방법은 작은 불꽃 착화시험에 의하며, 그 방법은 다음과 같다.
㉠ 시험장소는 온도 20℃, 습도 50%, 1기압, 무풍의 장소로 할 것
㉡ 두께 10㎜ 이상의 무기질 단열판 위에 시험물품 (건조용 실리카겔을 넣은 데시케이터 속에 온도 20℃로 24시간 이상
보존되어 있는 것) 3 ㎤ 정도로 둘 것. 이 경우 시험물품이 분말상 또는 입자상이면 무기질의 단열판 위에 반구상(半球
狀)으로 둔다.
㉢ 액화석유가스의 불꽃 [선단이 봉상(棒狀)인 착화기구의 확산염으로서 화염의 길이가 해당 착화기구의 구멍이 위로
향한 상태로 70 ㎜가 되도록 조절한 것]을 시험물품에 10초간 접촉 (화염과 시험물품의 접촉면적은 2 ㎠로 하고 접촉
각도는 30°로 한다)시킬 것
㉣ ㉡ 및 ㉢의 조작을 10회 이상 반복하여 화염을 시험물품에 접촉할 때 부터 시험물품이 착화할 때까지의 시간을 측정
하고, 시험물품이 1회 이상 연소 (불꽃없이 연소하는 상태를 포함한다)를 계속하는지 여부를 관찰할 것.
② ①의 방법에 의한 시험결과 불꽃을 시험물품에 접촉하고 있는 동안에 시험물품이 모두 연소하는 경우, 불꽃을 격리시
킨 후 10초 이내에 연소물품 전부 연소한 경우 또는 불꽃을 격리시킨 후 10초 이상 계속하여 시험물품이 연소한 경우
에는 가연성 고체에 해당하는 것으로 한다.
나. 고체의 인화 위험성 시험방법
인화성 위험성 시험은 인화점 측정에 의하며, 그 방법은 다음과 같다.
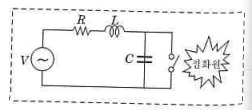
① 시험장치는 「페인트, 바니시, 석유 및 관련제품 - 인화점 시험방법 - 신속평형법」 (KS M ISO 3679)에 의한 인화점
측정기 또는 이에 준하는 것으로 할 것
② 시험장소는 1기압의 무풍의 무풍장소로 할 것
③ 다음 그림의 신속평형법 시료컵을 설정온도 (시험물품이 인화하는지의 여부를 확인하는 온도를 말한다. 이하 같다)까
지 가열 또는 냉각하여 시험물품(설정온도가 상온보다 낮은 온도인 경우에는 설정온도까지 냉각시킨 것) 2g을 시료컵
에 넣고 뚜껑 및 개폐기를 닫을 것

④ 시료컵의 온도를 5분간 설정온도로 유지할 것
⑤ 시험불꽃을 점화하고 화염의 크기를 직경 4㎜가 되도록 조정할 것
⑥ 5분 경과 후 개폐기를 작동하여 시험불꽃을 시료컵에 2.5초간 노출시키고 닫을 것. 이 경우 시험불꽃을 급격히 상하로
움직이지 아니하여야 한다.
⑦ ⑥의 방법에 의하여 인화한 경우에는 인화하지 않게 될 때까지 설정온도를 낮추고, 인화하지 않는 경우에는 인화할 때
까지 높여 ③ 내지 ⑥의 조작을 반복하여 인화점을 측정할 것
4. 가연성 고체 각론
【 지정수량 100 ㎏】
가. 황화인
① 일반적 성질

㉠ 삼황화인(P4S3) : 물, 황산, 염산 등에는 녹지 않고, 질산이나 이황화탄소(CS2), 알칼리 등에 녹는다.
㉡ 오황화인(P2S5) : 알코올이나 이황화탄소(CS2)에 녹으며, 물이나 알칼리와 반응하면 분해되어 황화수소(H2S)와 인산
(H3PO4)으로 된다. ★★
P2S5 + 8H2O → 5H2S + 2H3PO4
㉢ 칠황화인(P4S7) : 이황화탄소(CS2), 물에는 약간 녹으며, 따뜻한 물에서는 급격히 분해되어 황화수소(H2S)와 인산
(H3PO4)이 생성된다.
② 위험성
㉠ 황화인의 미립자를 흡수하면 기관지 및 눈의 점막을 자극한다.
㉡ 가연성 고체 물질로서 약간의 열에 의해서도 대단히 연소하기 쉬우며, 조건에 따라 폭발한다.
㉢ 연소생성물은 매우 유독하다.
P4S3 + 8O2 → 2P2O5 + 3SO2
2P2S5 + 15O2 → 2P2O5 + 10SO2
㉣ 알코올, 알칼리, 아민류, 유기산, 강산 등과 접촉하면 심하게 반응한다.
㉤ 단독 또는 무기과산화물류, 과망가니즈산염류, 납 등의 금속분, 유기물 등과 혼합하는 경우 가열, 충격, 마찰에 의해
발화 또는 폭발한다.
③ 저장 및 취급방법
㉠ 소량인 경우 유리병에 저장, 대량인 경우 양철통에 넣은 후 나무상자에 보관한다.
㉡ 산화제, 과산화물류, 알칼리, 아민류, 유기산, 강산 등과의 접촉을 피하고 용기는 차고 건조하며 통풍이 잘 되는 안전한
곳에 저장한다.
㉢ 가열금지, 직사광선 차단, 화기를 엄금하고, 충격과 마찰을 피한다.
㉣ 용기는 밀폐하여 보존하고, 물과 반응하므로 습기의 차단과 빗물 등의 침투에 항상 주의하여 보관한다.
④ 소화방법 : 화재시 CO2, 건조 소금분말, 마른 모래 등으로 질식 소화하며, 누설된 증기에 대해서는 물분무에 의하여
회수하여야 한다. 특히, 연소생성물이 대단히 유독하므로 보호장구의 착용은 필수이다.
⑤ 용도
㉠ 삼황화인 : 성냥, 유기합성 탈색 등
㉡ 오황화인 : 선광제, 윤활유 첨가제, 농약 제조 등
㉢ 칠황화인 : 유기합성 등
나. 적린 (P, 붉은 인)
① 일반적 성질
㉠ 원자량 : 31, 비중 : 2.2, 융점 : 600 ℃, 발화온도 : 260℃, 승화온도 : 400 ℃
㉡ 조해성이 있으며, 물, 이황화탄소, 에테르, 암모니아 등에는 녹지 않는다.
㉢ 암적색의 분말로 황린의 동소체이지만 자연발화의 위험이 없어 안전하며, 독성도 황린에 비하여 약하다.
② 위험성
㉠ 염소산염류, 과염소산염류 등 강산화제와 혼합하면 불안정한 폭발물과 같이 되어 약간의 가열, 충격, 마찰에 의해 폭발
한다.
6P + 5KClP3 → 5KCl + 3P2O5
㉡ 연소하면 황린이나 황화인과 같이 유독성이 감한 백색의 오산화인이 발생하며, 일부 포스핀도 발생한다. ★★
4P + 5O2 → 2P2O5
㉢ 불순물로 황린이 혼재하는 경우 자연발화의 위험이 있다.
㉣ 강알칼리와 반응하여 포스핀을 생성하고 할로겐 원소 중 Br2, I2와 격렬히 반응하면서 혼촉발화한다.
③ 저장 및 취급방법
㉠ 화기엄금, 가열금지, 충격, 타격, 마찰이 가해지지 않도록 한다.
㉡ 제1류 위험물과 절대 혼합되지 않게 하고, 화약류, 폭발성 물질, 가연성 물질 등과 격리하여 냉암소에 보관한다.
④ 소화방법 : 다량의 물로 소화하고 소량인 경우에는 모래나 CO2도 효과가 있다. 그러나 폭발의 위험이 있으므로 안전
거리의 확보와 연소생성물이 독성이 강하므로 보호장구를 반드시 착용해야 한다.
⑤ 용도 : 성냥, 불꽃놀이, 의약, 농약, 유기합성, 구리의 탈탄, 폭음제 등
다. 황 (S)
황은 순도가 60wt% 미만인 것을 제외한다. 이 경우 순도 측정에 있어서 불순물은 활석 등 불연성 물질과 수분에 한한다.
① 일반적 성질
|
구 분
|
단사황(S8)
|
사방황(S8)
|
고무상황(S8)
|
|
결정형
|
바늘모양(침상)
|
팔면체
|
무정형
|
|
비중
|
1.95
|
2.07
|
-
|
㉠ 황색의 결정 또는 미황색의 분말로서 단사황, 사방황 및 고무상황 등의 동소체가 있다.
(동소체 : 같은 원소로 되어 있으나 구조가 다른 단체)
㉡ 물, 산에는 녹지 않으며 알코올에는 약간 녹고, 이황화탄소(CS2)에는 잘 녹는다.
(단, 고무상황은 녹지 않는다)
㉢ 공기중에서 연소하면 푸른 빛을 내며 아황산가스(SO2)가 발생한다.
S + O2 → SO2
㉣ 분자량 : 32, 융점 : 120℃, 비점 : 444℃, 인화점 : 207℃, 발화점 : 232℃, 비중: 2.07
② 위험성
㉠ 연소가 매우 쉬운 가연성 고체로 유독성의 이산화황가스가 발생하고, 연소할 때 연소열에 의해 액화하고 증발한 증기
가 연소한다.
㉡ 제1류 위험물과 같은 산화성 물질과 혼합시 약간의 가열이나 충격 등에 의해 발화, 폭발한다. ( ex : 흑색화약)
㉢ 황가루가 공기 중에 부유할 때 분진폭발의 위험이 있다.
③ 저장 및 취급방법
㉠ 산화제와 멀리하고 화기 등에 주의한다.
㉡ 절연성으로 인해 정전기에 의한 발화가 가능하므로 정전기의 축적을 방지하고, 가열, 충격, 마찰 등은 피한다.
㉢ 분말은 분진폭발의 위험이 있으므로 취급시 유의하여야 한다.
㉣ 제1류 위험물과 같은 강산화제, 유기과산화물, 탄화수소류, 화약류, 목탄분, 산화성 가스와의 혼합을 피한다.
④ 소화방법 : 소규모의 화재시는 모래로 질식소화하나, 보통은 직사주수는 비산의 위험이 있으므로 다량의 물로 분무주수
에 의해 냉각소화한다.
⑤ 용도 : 화약, 고무상황, 이황화탄소(CS2)의 제조, 성냥, 의약, 농약, 살균, 살충, 염료, 표백 등
【지정수량 - 500 ㎏】
라. 마그네슘 (Mg)
마그네슘 또는 마그네슘을 함유한 것 중 2㎜의 체를 통과하지 아니하는 덩어리는 제외
① 일반적 성질

㉠ 삼황화인(P4S3) : 물, 황산, 염산 등에는 녹지 않고, 질산이나 이황화탄소(CS2), 알칼리 등에 녹는다.
㉡ 오황화인(P2S5) : 알코올이나 이황화탄소(CS2)에 녹으며, 물이나 알칼리와 반응하면 분해되어 황화수소(H2S)와 인산
(H3PO4)으로 된다. ★★
P2S5 + 8H2O → 5H2S + 2H3PO4
㉢ 칠황화인(P4S7) : 이황화탄소(CS2), 물에는 약간 녹으며, 따뜻한 물에서는 급격히 분해되어 황화수소(H2S)와 인산
(H3PO4)이 생성된다.
② 위험성
㉠ 황화인의 미립자를 흡수하면 기관지 및 눈의 점막을 자극한다.
㉡ 가연성 고체 물질로서 약간의 열에 의해서도 대단히 연소하기 쉬우며, 조건에 따라 폭발한다.
㉢ 연소생성물은 매우 유독하다.
P4S3 + 8O2 → 2P2O5 + 3SO2
2P2S5 + 15O2 → 2P2O5 + 10SO2
㉣ 알코올, 알칼리, 아민류, 유기산, 강산 등과 접촉하면 심하게 반응한다.
㉤ 단독 또는 무기과산화물류, 과망가니즈산염류, 납 등의 금속분, 유기물 등과 혼합하는 경우 가열, 충격, 마찰에 의해
발화 또는 폭발한다.
③ 저장 및 취급방법
㉠ 소량인 경우 유리병에 저장, 대량인 경우 양철통에 넣은 후 나무상자에 보관한다.
㉡ 산화제, 과산화물류, 알칼리, 아민류, 유기산, 강산 등과의 접촉을 피하고 용기는 차고 건조하며 통풍이 잘 되는 안전한
곳에 저장한다.
㉢ 가열금지, 직사광선 차단, 화기를 엄금하고, 충격과 마찰을 피한다.
㉣ 용기는 밀폐하여 보존하고, 물과 반응하므로 습기의 차단과 빗물 등의 침투에 항상 주의하여 보관한다.
④ 소화방법 : 화재시 CO2, 건조 소금분말, 마른 모래 등으로 질식 소화하며, 누설된 증기에 대해서는 물분무에 의하여
회수하여야 한다. 특히, 연소생성물이 대단히 유독하므로 보호장구의 착용은 필수이다.
⑤ 용도
㉠ 삼황화인 : 성냥, 유기합성 탈색 등
㉡ 오황화인 : 선광제, 윤활유 첨가제, 농약 제조 등
㉢ 칠황화인 : 유기합성 등
나. 적린 (P, 붉은 인)
① 일반적 성질
㉠ 원자량 : 31, 비중 : 2.2, 융점 : 600 ℃, 발화온도 : 260℃, 승화온도 : 400 ℃
㉡ 조해성이 있으며, 물, 이황화탄소, 에테르, 암모니아 등에는 녹지 않는다.
㉢ 암적색의 분말로 황린의 동소체이지만 자연발화의 위험이 없어 안전하며, 독성도 황린에 비하여 약하다.
② 위험성
㉠ 염소산염류, 과염소산염류 등 강산화제와 혼합하면 불안정한 폭발물과 같이 되어 약간의 가열, 충격, 마찰에 의해 폭발
한다.
6P + 5KClP3 → 5KCl + 3P2O5
㉡ 연소하면 황린이나 황화인과 같이 유독성이 감한 백색의 오산화인이 발생하며, 일부 포스핀도 발생한다. ★★
4P + 5O2 → 2P2O5
㉢ 불순물로 황린이 혼재하는 경우 자연발화의 위험이 있다.
㉣ 강알칼리와 반응하여 포스핀을 생성하고 할로겐 원소 중 Br2, I2와 격렬히 반응하면서 혼촉발화한다.
③ 저장 및 취급방법
㉠ 화기엄금, 가열금지, 충격, 타격, 마찰이 가해지지 않도록 한다.
㉡ 제1류 위험물과 절대 혼합되지 않게 하고, 화약류, 폭발성 물질, 가연성 물질 등과 격리하여 냉암소에 보관한다.
④ 소화방법 : 다량의 물로 소화하고 소량인 경우에는 모래나 CO2도 효과가 있다. 그러나 폭발의 위험이 있으므로 안전거
리의 확보와 연소생성물이 독성이 강하므로 보호장구를 반드시 착용해야 한다.
⑤ 용도 : 성냥, 불꽃놀이, 의약, 농약, 유기합성, 구리의 탈탄, 폭음제 등
다. 황 (S)
황은 순도가 60wt% 미만인 것을 제외한다. 이 경우 순도 측정에 있어서 불순물은 활석 등 불연성 물질과 수분에 한한다.
① 일반적 성질
㉠ 알칼리토금속에 속하는 대표적인 경금속으로 은백색의 광택이 있는 금속이며 공기 중에서 서서히 산화하여 광택을
잃는다.
㉡ 열전도율 및 전기전도도가 큰 금속이다.
㉢ 산 및 온수와 반응하여 많은 양의 열과 수소(H2)가 발생한다. ★★
Mg + 2HCl → MgCl2 + H2
Mg + 2H2O → Mg(OH)2 + H2
㉣ 공기중 부식성은 적지만, 산이나 염류에는 침식된다.
㉣ 원자량 : 24, 비중 : 1.74, 융점 : 65℃, 비점 : 1,107℃, 착화온도 : 473℃
② 위험성
㉠ 공기중에서 미세한 분말이 밀폐공간에 부유할 때 스파크 등 작은 점화원에 의해 분진폭발한다.
㉡ 얇은 박, 부스러기도 쉽게 발화하고, PbO2, Fe2O3, N2O, 할로겐 및 1류 위험물과 같은 강산화제와 혼합된 것은 약간
의 가열, 충격, 마찰 등에 의해 발화, 폭발한다.
㉢ 상온에서는 물을 분해하지 못하여 안정하지만 뜨거운 물이나 과열 수증기와 접촉시 격렬하게 수소가 발생하며 염화암
모늄 용액과의 반응은 위험을 초래한다.
㉣ 가열하면 연소가 쉽고 양이 많은 경우 맹렬히 연소하며 강한 빛을 낸다. 특히 연소열이 매우 높기 때문에 온도가 높아
지고 화세가 격렬하여 소화가 곤란하다.
2Mg + O2 → 2MgO
㉤ CO2 등 질식성 가승와 접촉시에는 가연성 물질인 C와 유독성인 CO가스가 발생한다.
2Mg + CO2 → 2MgO + C
Mg + CO2 → 2MgO + CO
㉥ 사염화탄소(CCl4)나 C2H4ClBr 등과 고온에서 작용시에는 맹독성인 포스겐(COCl2) 가스가 발생한다.
㉦ 가열된 마그네슘을 SO2 속에 넣으면 SO2 가 산화제로 작용하여 연소한다.
3Mg + SO2 → 2MgO + MgS
㉧ 질소 기체 속에도 타고 있는 마그네슘을 넣으면 직접 반응하여 공기나 CO2 속에서 보다 활발하지는 않지만 연소한다.
3Mg + N2 → Mg3N2
③ 저장 및 취급방법
㉠ 가열, 충격, 마찰 등을 피하고 산화제, 수분, 할로겐 원소와의 접촉을 피한다.
㉡ 분진폭발의 위험이 있으므로 분진이 비산되지 않도록 취급시 주의한다.
④ 소화방법 : 일단 연소하면 소화가 곤란하나 초기 소화 또는 대규모 화재시는 석회분, 마른 모래 등으로 소화하고, 기타의
경우 다량의 소화분말, 소석회, 건조사 등으로 질식소화한다. 특히, 물, CO2, N2, 포, 할로겐 화합물 소화약
제는 소화 적응성이 없으므로 절대 사용을 엄금한다.
⑤ 용도 : 환원제(Grignard 시약), 주물 제조, 섬광분, 사진 촬영, 알루미늄 합금에의 첨가제 등으로 이용
마. 철분 (Fe)
철분이라 함은 철은 분말로서 53㎛의 표준체를 통과하는 것이 50wt% 미만인 것은 제외한다.
① 일반적 성질
㉠ 비중 : 7.86, 융점 : 1,535℃, 비등점 : 2,750 ℃
㉡ 회백색의 분말이며 강자성체이지만 766℃ 에서 강자성을 상실한다.
㉢ 공기중에서 서서히 산화하여 산화철(Fe2O3)이 되어 은백색의 광택이 황갈색으로 변한다.
4Fe + 3O2 → 2FeO3
㉣ 강산화제인 발연질산에 넣었다 꺼내면 산화피복을 형성하여 부동태가 된다.
② 위험성
㉠ 연소하기 쉽고 기름이 묻은 철분을 장기 방치하면 자연발화의 위험이 있다. 특히 미세한 분말일 수록 작은 점화원에
의해 발화, 폭발한다.
㉡ 뜨거운 철분, 철솜과 브로민이 접촉하면 격렬하게 발열반응을 일으키고 연소한다.
2Fe + 3Br2 → 2FeBr3
㉢ 가열되거나 금속의 온도가 높은 경우 더운 물 또는 수증기와 반응하면 수소가 발생하고 경우에 따라 폭발한다.
또한 묽은 산과 반응하여 수소가 발생한다. ★★
2Fe + 2H2O → Fe2O3 + 3H2
Fe + 2HCl → FeCl2 + H2
2Fe + 6HCl → 2FeCl3 + 3H2
㉣ KClO3, NaClO3 와 혼합한 것은 약간의 충격에 의해서 폭발하며 HClO4와 격렬히 반응하여 산화물을 만든다.
③ 저장 및 취급방법
㉠ 가열, 충격, 마찰 등을 피한다.
㉡ 산화제와 격리하고 수분의 접촉을 피한다.
㉢ 직사광선을 피하고, 냉암소에 저장한다.
④ 소화방법 : 주수엄금, 마른 모래, 소금분말, 건조분말, 소석회로 질식소화한다.
⑤ 용도 : 각종 철화합물의 제조, 유기합성시 촉매, 환원제 등으로 이용한다.
바. 금속분
금속분이라 함은 알칼리금속, 알칼리토금속, 철 및 마그네슘 이외의 금속분을 말하여, 구리, 니켈분과 150㎛의 체를 통과
하는 것이 50wt% 미만인 것을 제외한다.
① 알루미늄분(Al)
㉮ 일반적 성질
㉠ 녹는점 : 660℃, 비중 : 2.7, 연성(퍼짐성), 전성(뽑힘성)이 좋으며, 열전도율, 전기전도도가 큰 은백색의 무른 금속으로
진한 질산에서는 부동태가 되며 묽은 질산에는 잘 녹는다.
㉡ 공기 중에서는 표면에 산화피막(산화알루미늄)을 형성하여 내부를 부식으로 부터 보호한다.
4Al + 3O2 → 2Al2O3
㉢ 다른 금속 산화물을 환원한다. 특히 Fe3O4와 강렬한 산화반응을 한다.
3Fe3O4 + 8Al → 4Al4O3 + 9Fe (테르밋 반응)
㉯ 위험성
㉠ 알루미늄 분말이 발화하면 다량의 열이 발생하며, 불꽃 및 흰 연기를 내면서 연소하므로 소화가 곤란하다.
4Al + 3O2 → 2Al2O3
㉡ 대부분의 산과 반응하여 수소가 발생된다. (단, 진한질산 제외)
2Al + 6HCl → 2AlCl3 + 3H2
㉢ 알칼리 수용액과 반응하여 수소가 발생한다.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
㉣ 제1류 위험물 같은 강산화제와의 혼합물은 약간의 가열, 충격, 마찰에 의해 발화 폭발한다.
㉤ 물과 반응하면 수소가스가 발생한다. ★★
2Al + 6H2O → 2Al(OH)3 + 3H2
㉰ 저장 및 취급방법
㉠ 소량인 경우 유리병에 저장, 대량인 경우 양철통에 넣은 후 나무상자에 보관한다.
㉡ 산화제, 과산화물류, 알칼리, 아민류, 유기산, 강산 등과의 접촉을 피하고 용기는 차고 건조하며 통풍이 잘 되는 안전한
곳에 저장한다.
㉢ 가열금지, 직사광선 차단, 화기를 엄금하고, 충격과 마찰을 피한다.
㉣ 용기는 밀폐하여 보존하고, 물과 반응하므로 습기의 차단과 빗물 등의 침투에 항상 주의하여 보관한다.
㉱ 소화방법 : 화재시 CO2, 건조 소금분말, 마른 모래 등으로 질식 소화하며, 누설된 증기에 대해서는 물분무에 의하여
회수하여야 한다. 특히, 연소생성물이 대단히 유독하므로 보호장구의 착용은 필수이다.
㉲ 용도 : 도료, 인쇄, 전선 등에 이용
② 아연분 (Zn)
㉮ 일반적 성질
㉠ 비중 : 7.142, 융점 : 420 ℃, 비점 : 907 ℃
㉡ 흐릿한 회색의 분말로 양쪽성 원소이므로 산, 알칼리와 반응하여 수소가 발생한다.
㉢ 황아연광을 가열하여 산화아연을 만들어 1,000℃ 에서 코크스와 반응하여 환원 시킨다.
2ZnS + 3O4 → 2ZnO + 2SO2
ZnO + C → Zn + CO
㉣ 아연분은 공기 중에서 표면에 흰 염기성의 탄산아연의 얇은 막을 만들어 내부를 보호한다.
2Zn + CO2 + H2O + O2 → Zn(OH)2 · ZnCO3
㉤ KCN 수용액과 암모니아수에 용해되며, 산소가 존재하는 물과 반응하여 수산화아연과 과산화수소를 생성한다.
㉥ 아연이 산과 반응하면 수소가스가 발생한다. ★★
Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
㉯ 위험성
㉠ 공기 중에서 융점 이상 가열 시 연소가 잘 된다.
4Zn + O2 → 2ZnO
㉡ 하이드록실아민, 염소산염류, 과염소산염유와 혼합한 것은 가열, 충격 등으로 발화, 폭발하며, NH4NO3와의 혼합물에
소량의 물을 가하면 발화의 위험이 있다.
㉢ 석유류, 황 등의 가연물이 혼입되면 산화발열이 촉진된다. 따라서, 윤활유 등이 혼입되면 기름의 특성에 따라 자연발화
의 위험이 있다.
㉰ 저장 및 취급방법 : 직사광선, 높은 온도를 피하며, 냉암소에 저장한다.
㉱ 소화방법 : 화재 초기에는 마른 모래 또는 건조분말로 질식소화하며, 물, 포에 의한 냉각소화는 적당하지 않다.
㉲ 용도 : 연막, 의약, 도료, 염색 가공, 유리 화학반응, 금속 제련 등에 이용
③ 안티몬분(Sb)
㉮ 일반적 성질
㉠ 비중 : 6.68, 융점 : 630 ℃, 비점 : 1,750 ℃, 은백색의 광택이 있는 금속으로 여러가지의 이성질체를 갖는다.
㉡ 진한 황산, 진한 질산 등에는 녹으나 묽은 황산에는 녹지 않는다.
㉢ 물, 염산, 묽은 황산, 알칼리 수용액에 녹지 않고, 왕수, 뜨겁고 진한 황산에는 녹으며, 뜨겁고 진한 질산과 반응을
한다.
2Sb + 10HNO3 → Sb2O3 + 5NO2 + H2O
㉯ 위험성
㉠ 흑색 안티몬은 공기 중에서 발화한다.
㉡ 무정형 안티몬은 약간의 자극 및 가열로 인하여 폭발적으로 회색 안티몬으로 변한다.
㉢ 약 630℃ 이상 가열하면 발화한다.
㉰ 저장 및 취급방법 : 직사광선, 높은 온도를 피하며, 냉암소에 저장한다.
㉱ 소화방법 : 화재 초기에는 마른 모래 또는 건조분말로 질식소화하며, 물, 포에 의한 냉각소화는 적당하지 않다.
㉲ 용도 : 활자의 주조, 베어링 합금, 촉매 등에 사용
④ 지르코늄분 (Zr)
㉮ 일반적 성질
㉠ 비중 : 6.5, 융점 : 1,850 ℃, 비점 : 4,400 ℃, 물리적으로 단단하고 겉모양은 은백색의 스테인리스와 유사하다.
㉡ 강도가 매우 크고 내부식성이 있어 유용한 금속재료로 쓰인다.
㉯ 위험성
㉠ 불화수소산과 반응하여 수소가 발생한다.
Zr + 7HF → H3ZrF7 + 2H2
㉡ 실온의 공기 중에서 산화피막을 형성하여 반응성은 적으나 분말이거나 가열하면 활성을 가지며 발화하여 이산화지르
코늄(ZrO2)이 된다.
㉢ 이산화탄소 중에서도 연소한다.
㉰ 저장 및 취급방법 : 직사광선, 높은 온도를 피하며, 냉암소에 저장한다.
㉱ 소화방법 : 화재 초기에는 마른 모래 또는 건조분말로 질식소화하며, 물, 포에 의한 냉각소화는 적당하지 않다.
㉲ 용도 : 합금, 섬광탄의 내관, 전자관 부품재료 등
【지정수량 : 1,000㎏】
사. 인화성 고체
인화성 고체라 함은 고형 알코올과 그 밖에 1기압에서 인화점이 40℃ 미만인 고체를 말한다.
① 고형 알코올
㉮ 합성수지에 메탄올을 혼합, 침투시켜 한천상으로 만든 것이다.
㉯ 30℃ 미만에서 가연성 증기가 발생하기 쉽고 인화하기 매우 쉽다.
㉰ 가열 또는 화염에 의한 화재의 위험이 매우 높다.
② 메타알데하이드 [metaldehyde, (CH3CHO)4]
㉮ 분자량 : 176, 인화점 : 36℃, 융점 : 246℃, 비점 : 112 ~ 116 ℃, 무색의 침상 또는 판상의 결정이다.
㉯ 물에 녹지 않으며 에테르, 에탄올, 벤젠에는 녹기 어렵다.
㉰ 증기는 공기보다 무거워서 낮은 곳에 체류할 위험이 있다.
㉱ 80℃에서 일부 분해되어 인화성이 강한 액체인 아세트알데하이드로 변해 더욱 위험해진다.
③ 제삼뷰틸알코올 [tert-butyl alcohol, (CH3)3COH]
㉮ 분자량 : 74, 인화점 : 11℃, 유점 : 25.6℃, 비점 : 83℃, 무색의 고체로서 물보다 가볍고 물에 잘 녹는다.
㉯ 정뷰틸알코올에 비해서 알코올로서의 특성이 적고 탈수제에 의해 가연성 기체로 변하여 더욱 위험해진다.
㉰ 상온에서 가연성의 증기 발생이 용이하고 증기는 공기보다 무거워서 낮은 곳에 체류하며 밀폐공간에서는 인화폭발의
위험이 크다.
㉱ 연소 열량이 커서 소화가 곤란하다.
#가연성고체 #강환원제 #철분 #마그네슘 #금속분 #산화제 #점화원 #적린 #황린 #황화인 #위험물 #제2류위험물 #인화성고체 #안티몬분 #지르코늄 #고형알코올
'위험물 기능장 > 위험물의 성질 및 취급' 카테고리의 다른 글
| 제6류 위험물 - 산화성 액체 (4) | 2025.01.11 |
|---|---|
| 제4류 위험물 - 인화성 액체 (0) | 2025.01.07 |
| 무수물, 무수산화물 / anhydride / 無水物 (0) | 2025.01.02 |
| 위험물 및 지정수량 (2) | 2025.01.01 |
| 연소생성물과 특성, 열 · 연기의 유동특성 (6) | 2025.01.01 |