농도에 관한 문제는 고등학교, 대학교, 그리고 자격증 시험에서 자주 등장하는
중요한 문제 유형 중 하나입니다.
몰농도, 몰농도공식, 몰랄농도, 퍼센트농도 등
다양한 농도 유형이 존재하므로,
이 개념들을 제대로 이해하지 못하면 혼란스러울 수 있습니다.
이 글에서는 이 세 가지 농도를 자유롭게 변환하고
몰농도공식 계산하는 방법에 대해 설명하려고 합니다.
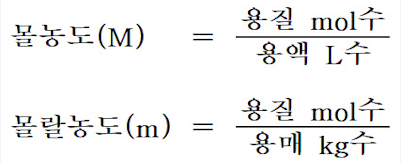
1. 몰농도
▣ 몰농도는 용질의 몰 수를 용매의 부피(ℓ)로 나눈 값으로 정의됩니다.
여기서 용질의 몰 수는 몰(mol) 단위를 말하며, 용매의 부피는 리터(ℓ) 단위로 계산됩니다.
공식만으로는 이해가 어려울 수 있으니,
예제를 통해 설명하면 더 쉽게 이해할 수 있습니다.
연습문제 1.
NaCl 58.44g을 1ℓ 물에 녹여 NaCl 수용액을 만들었습니다.
이때의 몰농도는 몇 M일까요?
NaCl 58.44g은 용질로 사용되었고,
1ℓ 물에 녹였으므로, 1ℓ의 물은 용매의 부피가 됩니다.
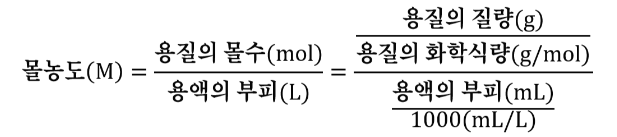
용질의 몰 수를 구하기 위해 NaCl의 분자량으로 질량을 나누어 몰 수를 계산합니다.
(질량 / 분자량 = 몰 수) 이 공식으로 몰 수를 구하고,
이를 용매의 부피로 나누면 1M(몰농도)를 얻을 수 있습니다.
2. 몰랄농도
몰랄농도는 용매 1kg당 녹아 있는 용질의 몰 수를 나타내며, 용질의 몰 수를 용매의 질량(kg)으로
나눈 값으로 정의됩니다.
연습문제 2.
NaCl 58.44g을 1ℓ 물에 녹여 NaCl 수용액을 만들었습니다.
이때의 몰랄농도는 몇 m일까요?
1번 문제와 마찬가지로 용질의 몰 수를 계산한 후,
용매의 부피를 질량으로 환산해야 합니다.
물 1ℓ의 부피를 cm3로 환산하고, 물의 밀도(1g / cm3)를
이용해 질량으로 환산합니다.
이를 통해 계산하면 1m(몰랄농도)를 얻을 수 있습니다.

3. 퍼센트농도
퍼센트농도는 용질의 질량을 용액의 총 질량으로 나눈 후 100을 곱해 얻는 값입니다.
이는 용매에 얼마나 많은 용질이 포함되어 있는지를 백분율로 나타낸 것입니다.
연습문제 3.
NaCl 58.44g을 1ℓ 물에 녹여 NaCl 수용액을 만들었습니다.
이때의 퍼센트농도는 몇 %일까요?
퍼센트농도를 구하기 위해, 용질의 질량과 용액의 총 질량을 계산해야 합니다.
용매의 질량을 구한 후, 용질의 질량을 더해 용액의 총 질량을 구합니다.
이를 통해 계산하면 5.52%의 퍼센트농도를 얻을 수 있습니다.
이 글을 통해 몰농도, 몰랄농도, 몰농도계산 퍼센트농도에 대해 알아보았습니다.
이 세 가지 농도는 시험뿐만 아니라 실무에서도 널리 사용됩니다.

공식을 사용할 때 단위 변환을 정확히 하는 것이 중요하며,
몰 수를 구하기 위해서는 화합물의 분자량을,
부피를 질량으로 환산할 때는 물질의 밀도를 알아야 합니다.
#몰농도 #몰랄농도 #퍼센트농도 #밀도 #부피 #질량 #용매 #용질 #용액
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 당량과 당량수 (2) | 2024.12.03 |
|---|---|
| 산화수 (Oxidation state) 계산방법 및 규칙 (0) | 2024.12.03 |
| 몰 (Molar) 농도 계산하기 (0) | 2024.12.02 |
| 당량 : 당량은 화학반응으로 결정된다. (2) | 2024.11.24 |
| 퍼센트 농도, 몰 농도, 노르말 농도 (0) | 2024.11.24 |
