1. 연소의 정의
연소 (Combustion)는 열과 빛을 동반하는 산화반응으로서 F2, Cl2, CO2, NO2 그리고 산소의 존재가 없는 몇몇 다른 가스(기체) 중에서 일어날 수도 있다. (예를 들면, 금속분 등은 CO2 중에서도 점화할 수 있다)
가. 완전 연소
더 이상 연소할 수 없는 연소생성물이 생성되는 연소를 말한다.
① 탄소 (흑연의 경우)의 연소 : C + O2 (g) → CO2 (g)
② 프로판 (C3H8)의 연소 : C3H8(g) + 5O2 (g) → 3CO2 (g) + 4H2O (ℓ)
③ 수소의 연소
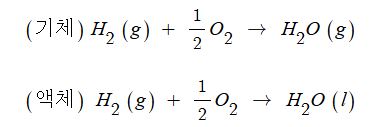
나. 불안전연소
부분적인 연소, 재연소가 가능한 생성물이 발생하는 연소를 말한다.
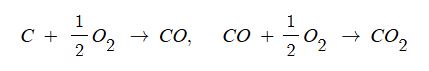
다. 산화반응이지만 연소반응이라 할 수 없는 경우
① 산화반응이나 발열이 나지 아니하거나 아주 미약한 발열반응인 경우
4Fe + 3O2 → 2Fe2O3
② 산화반응이나 흡열반응인 경우
N2 + O2 → 2NO - 43.2 kcal (산화반응이지만 흡열반응식)
라. 유기화합물이 대기중에서 연소할 경우 완전연소 생성물은 CO2 와 H2O이며 불완전연소인 경우에는 C, CO, CO2,
H2O, H2 등이 생성된다.
2. 연소의 구비조건
가. 연소의 필수요소
연소는 연소되는 물질인 가연성 물질, 가연성 물질을 산화시키는 데 필요한 조연성 물질 (산소 공급원), 가연성 물질과
조연성 물질을 활성화 시키는 데 필요한 에너지인 점화원이 필요하며, 이러한 3가지 요소를 연소의 3요소라 한다. 그러나
일반적으로 연소가 계속적으로 진행되기 위해서는 연소의 3요소 이외에 연속적인 연쇄반응이 수반되어야 한다. 이와같이
가연성 물질, 산소공급원, 점화원 및 연쇄반응을 연소의 4요소라 한다.
◈ 연소의 3요소 : 가연성 물질, 산소공급원, 점화원
◈ 연소의 4요소 : 가연성 물질, 산소공급원, 점화원, 연쇄반응
나. 연소의 4요소 특징
① 가연성 물질 : 연소가 일어나는 물질로 발열을 일으키며, 산화반응을 하는 모든 물질로 환원제이며 다음과 같은 조건이
필요하다.
㉠ 산소와의 친화력이 클 것
㉡ 고체 · 액체에서는 분자구조가 복잡해질 수록 열전도율이 작을 것
(단, 기체분자의 경우 단순할 수록 가볍기 때문에 확산속도가 빠르고 분해가 쉽다.
따라서, 열전도율이 클수록 연소폭발의 위험이 있다.)
㉢ 활성화 에너지가 적을 것
㉣ 연소열이 클 것
㉤ 크기가 작고 접촉면적이 클 것
② 산소공급원 (조연성 물질) : 가연성 물질의 산화반응을 도와주는 물질로 산화제이다.
공기, 산화제 (제1류 위험물, 제6류 위험물 등), 자기반응성 물질 (제5류 위험물), 할로겐 원소 등이 대표적인 조연성
물질이다.
③ 점화원 (열원, heat energy source) : 어떤 물질의 발화에 필요한 최소 에너지를 공급할 수 있는 것으로 정의할 수 있으
며, 일반적인 불꽃과 같은 점화원 외에 다음과 같은 것들이 있다.
㉠ 화학적 에너지원 : 반응열 등으로 산화열, 연소열, 분해열, 융해열 등
㉡ 전기적 에너지원 : 저항열, 유도열, 유전열, 정전기열 (정전기 불꽃), 낙뢰에 의한 열, 아크방전 (전기불꽃 에너지) 등
㉢ 기계적 에너지원 : 마찰열, 마찰 스파크 (충격열), 단열 압축열 등
④ 연쇄반응 : 가연성 물질이 유기화합물인 경우 불꽃 연소가 개시되어 열을 발생하는 경우 발생된 열은 가연성 물질의
형태를 연소가 용이한 중간체 (화학에서 자유 라디칼이라 함)로 형성하여 연소를 촉진시킨다. 이와 같이
에너지에 의해 연소가 용이한 라디칼의 형성은 연쇄적으로 이루어지며, 점화원이 제거되어도 생성된 라디
칼이 완전하게 소실되는 시점까지 연소를 지속시킬 수 있다. 이러한 현상을 연쇄반응이라고 말하며, 이것
을 연소의 3요소에 추가하여 연소의 4요소라고 한다.
3. 온도에 따른 불꽃의 색상
|
불꽃의 온도
|
불꽃의 색상
|
불꽃의 온도
|
불꽃의 색상
|
|
500 ℃
|
적열
|
1,100 ℃
|
황적색
|
|
700 ℃
|
암적색
|
1,300 ℃
|
백적색
|
|
850 ℃
|
적색
|
1,500 ℃
|
휘백색
|
|
950 ℃
|
휘적색
|
-
|
-
|
4. 연소의 분류
가. 정상연소
가연성 물질이 서서히 연소하는 현상으로 연소로 인한 열의 발생속도와 열의 확산속도가 평행을 유지하면서 연소하는 형태이다. 가연물의 성질에 따라서 그 연소속도는 일정하지 않으며 난연성 (難燃性), 이연성 (易燃性), 속연성 (速燃性) 등의 말로 표현되나 어떠한 경우에 있어서도 연소의 경우는 열의 전도이다. 작게는 성냥개비와 담배가 타는 경우에서 부터 크게는 보일러 등에서 연료가 타는 경우 등이다. 즉, 화원으로 부터 끊임없이 타는 것이 연소의 특징이다.
나. 접염연소
불꽃이 물체와 접촉함으로써 착화되어 연소되는 현상이다. 불꽃의 온도가 높을 수록 타기 쉽다. 이 경우 불꽃이 직접 닿는 곳에는 전도 불꽃이, 가까운 곳에는 복사에 의하여, 멀어질 수록 대류에 의하여 주로 발생한다. 그러나 불꽃은 끊임없이 동요하므로 결국은 전도, 복사, 대류가 가 같이 작용하는 것이라고 보아야 할 것이다.
다. 대류연소
열기가 흘러 그 기류가 가연성 물질을 가열함으로써 끝내는 그 물질을 착화하여 연소로 유도하는 현상을 말한다. 대류 연소는 기류의 온도가 그다지 높지 아니한 때는 문제가 될 것이 없으나 불꽃이 연소되는 고열이나 또는 고열상태에 있을 때에는 대단히 위험하다.
라. 복사연소
연소체로 부터 발산하는 열에 의하여 주위의 가연성 물질에 인화하여 연소를 전개하는 현상이다. 복사열은 그 자체는 육안으로는 식별되지 않으므로 당장 그 작용이 격렬히 진행되고 있어도 대상물에 발화될 까지는 판별을 못하여 결국 화재방어에 실패하는 때도 있다. 복사열은 본래 열원의 작용이며 그 작용은 열원의 쌍방에서 사방으로 파급된다.
마. 비화연소
불티가 바람에 날리거나 혹은 튀어서 발화점에서 떨어진 곳에 있는 대상물에 착화하여 연소되는 현상이다. 비화연소에
대한 화재방어상의 문제는 화원에서 상당한 거리에 있는 장소엪 다수의 새로운 발화점을 만든다는 것이다. 이 불티는 대소가 있으며 그것이 크면 클수록 위험률이 높은 것이다. 그러나 때로는 작은 불티라도 바람, 온도 등의 관계로 화재에 이르게 하는 수가 있다. 또한 불티의 비산거리와 범위는 연소 중인 물질의 종류, 발화점의 분화력, 풍력 등에 따라서 달라진다.
5. 연소의 형태 (물질의 상태에 따른 분류)
가. 기체의 연소
① 확산연소 (불균일 연소) : '가연성 가스'와 공기를 미리 혼합하지 않고 산소의 공급을 '가스의 확산에 의하여 주위에
공기와 혼합, 연소하는 것. 산소의 공급을 주위의 공기로 부터 얻으므로 특별한 경우를 제외하고는 불꽃의 위치나 모
양이 변하지 않는 정상연소이기는 하나, 확산에 의해 공기와 접촉할 수 있는 부분에서만 연소가 일어나므로 불의
세기는 약하며 충분한 연소가 일어나기 어렵다.
② 예혼합연소 (균일연소) : '가연성 가스'와 공기를 혼합하여 연소시키는 것. 즉, 가연성 기체를 공기와 일정한 비율로
혼합시켜 놓고 혼합기체를 점화에 의해 점화하여 연소하는 방식으로 '가연성 가스'와 공기가 적당히 잘 혼합되어
있어 반응이 빠르고 온도도 높아 폭발적인 연소가 일어나기도 하며, 이러한 형식의 불꽃을 예혼염이라 한다.
나. 액체의 연소
① 액면연소 : 열원으로 부터 연료 표면에 열이 전달되어 증발이 일어나고 발생된 증기가 공기와 접촉하여 유면의 상부에
서 확산연소를 하지만 화염 시에 볼 수 있을 뿐 실용 예는 거의 없는 연소 형태이다.
② 심화연소 : 모세관현상에 의해 심지의 일부분으로 부터 연료를 빨아 올려서 다른 부분으로 전달되어 거기서 연소열을
받아 증발된 증기가 확산연소하는 형태이다.
③ 분무연소(액적연소) : 점도가 높고, 비휘발성인 액체를 안개상으로 분사하여 액체의 표면적을 넓혀 연소시키는 형태이
다.
④ 증발연소 : 가연성 액체를 외부에서 가열하거나 연소열이 미치면 그 액표면에 가연 가스 (증기)가 증발하여 연소되는
현상을 말한다. 예를 들어, 등유에 점화하면 등유의 상층 액면과 화염 사이에는 어느 정도의 간격이 생기는
데, 이 간격은 바로 등유에서 발생한 증기의 층이다 (알코올, 휘발유).
⑤ 분해연소 : 비휘발성이거나 끓는 점이 높은 가연성 액체가 연소할 때는 먼저 열분해하여 탄소가 석출되면서 연소하는
데, 이와 같은 연소를 말한다.
다. 고체의 연소 ★★★
① 표면 연소 (직접연소) : 열분해에 의하여 가연성 가스가 발생하지 않고 그 자체가 연소하는 형태로서 연소반응이 고체
의 표면에서 이루어지는 형태이다.
ex : 목탄, 코크스, 금속분 등
② 분해 연소 : '가연성 가스'가 공기 중에서 산소와 혼합되어 타는 현상이다.
ex : 목재, 석탄, 종이 등
③ 증발 연소 : 가연성 고체에 열을 가하면 융해되어 여기서 생긴 액체가 기화되고 이로 인한 연소가 이루어지는
형태이다.
ex : 양초, 황, 나프탈렌, 장뇌 등
④ 내부연소 (자기연소) : 물질 자체의 분자 안에 산소를 함유하고 있는 물질이 연소시 외부에서의 산소공급을 필요로
하지 않고 물질 자체가 갖고 있는 산소를 소비하면서 연소하는 형태이다.
ex : 질산에스터류, 나이트로화합물류 등
6. 연소에 관한 물성
가. 인화점 (flash point)
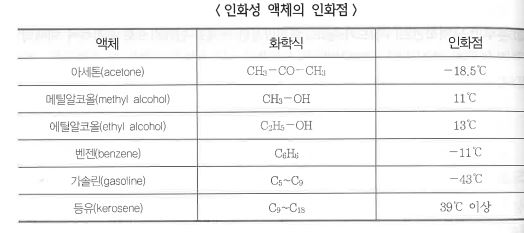
가연성 액체를 가열하면서 액체의 표면에 점화원을 주었을 때 증기가 인화하는 액체의 최저온도를 인화점 혹은 인화온도라 하며 이는 인화가 일어나는 액체의 최저 온도이다.
나. 연소점 (fire point)
상온에서 액체 상태로 존재하는 가연성 물질의 연소상태를 5초 이상 유지시키기 위한 온도를 의미하며, 일반적으로 인화점 보다 약 5~10℃ 정도 높은 온도이다.
다. 발화점 (ignition point, 발화온도, 착화점, 착화온도)
① 가연성 물질 또는 혼합물을 공기 중에서 일정한 온도 이상으로 가열하면 가연성 가스가 발생되어 계속적인 가열에 의
하여 화염이 존재하지 않는 조건ㅁ에서 점화한다. 즉, 점화원을 부여하지 않고 가연성 물질을 조연성 물질과 공존하는
상태에서 가열하여 발화하는 최저의 온도이다.
② 발화점이 낮을 수록 위험성은 증가한다.
③ 발화점은 조건에 따라 다양한 수치가 나오므로 비점이나 증기압과 같은 물리적인 상수값은 아니다.
④ 발화점에 미치는 중요한 요인으로 가열하는 시간, 촉매 유무, 가연물과 산화제의 혼합, 혼합물의 양, 용기의 상태, 압력,
점화원의 종류 등이 있으며 표는 가연성 가스의 공기 중 발화점을 여러가지 측정방법으로 측정한 값들을 요약하였다.
<가연성 물질의 발화온도 (착화온도)>
|
물질
|
발화온도(℃)
|
물질
|
발화온도(℃)
|
물질
|
발화온도(℃)
|
|
메탄
|
615~682
|
가솔린
|
약 300
|
코크스
|
450 ~ 550
|
|
프로판
|
460~520
|
목탄
|
250 ~ 320
|
건조한 목재
|
280 ~ 300
|
|
부탄
|
430~510
|
석탄
|
330 ~ 450
|
등유
|
약 210
|
[참고] 인화점이 낮다고 발화점도 낮은 것은 아니다. 예를 들어, 가솔린의 경우 인화점은 -43 ℃로 등유 보다 낮지만, 발화점
은 300 ℃ 로 등유 보다 높다.
라. 최소 착화에너지 (최소 점화에너지)
① 가연성 혼합가스에 전기불꽃으로 점화시 착화하기 위해 필요한 최소 에너지를 말한다.
② 최소 착화에너지는 혼합가스의 종류, 농도, 압력에 따라 다르며, 이론 농도 혼합기 부근에서 일반적으로 최소가 된다.
③ 최소 착화에너지가 적을 수록 폭발하기 쉽고 위험하다.
④ 최소 착화에너지 (E)를 구하는 공식
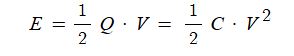
여기서, E : 착화에너지 (J).
Q : 전기량 (C)
V : 방전전압 (Volt)
C : 전기 (콘덴서) 용량 (F)
마. 연소범위 (연소한계, 가연범위, 가연한계, 폭발범위, 폭발한계)
연소가 일어나는 데 필요한 조연성 가스 (일반적으로 공기) 중에 가연성 가스의 농도 (vol %) 이다.
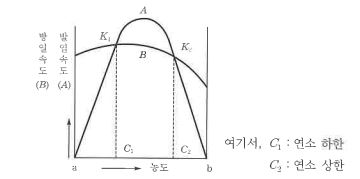
① 연소하한 (LEL) : 공기 또는 조연성 가스 중에서 연소가 발생할 수 있는 가연성 가스의 최소의 농도
② 연소상한 (UEL) : 공기 또는 조연성 가스 중에서 연소가 발생할 수 있는 가연성 가스의 최고의 농도
③ 연소범위 : 혼합가스의 연소가 발생하는 상한값과 하한값 사이
㉠ 온도의 영향 : 온도가 증가하면 연소 하한은 낮아지고 연소상한은 높아지는 경향에 의해 연소범위는 넓어진다.
㉡ 압력의 영향 : 압력이 증가할 수록 연소 하한값은 변화하지 않지만, 연소 상한값이 증가하여 연소범위는 넓어진다.
㉢ 농도의 영향 : 조연성 가스의 농도가 증가할 수록 연소상한이 증가하므로 연소범위는 넓어진다.
7. 연소의 이상현상
가. 선화 (lifting)
연료가스의 분출속도가 연소속도 보다 빠를 때 불꽃이 버너의 노즐에서 떨어져 나가서 연소하는 현상으로 완전연소가 이루어지지 않으며 역화의 반대현상
나. 역화 (back fire)
① 역화 : 연료가스의 분출속도가 연소속도 보다 느릴 때 불꽃이 연소기 내부로 들어가 혼합관 속에서 연소하는 현상
② 역화의 원인
㉠ 버너가 과열될 때
㉡ 혼합가스량이 너무 적을 때
㉢ 연료의 분출속도가 연소속도 보다 느릴 때
㉣ 압력이 높을 때
㉤ 노즐의 부식으로 분출 구멍이 커진 경우
다. 블로오프 (blow - off) 현상
산화상태에서 연료가스의 분출속도가 증가하거나 주위 공기의 유동이 심하면 화염이 노즐에서 연소하지 못하고 떨어
져서 화염이 꺼지는 현상
#연소 #점화원 #불꽃 #점염연소 #비화 #예혼합연소 #인화점 #연소점 #발화점 #연소한계 #폭발범위 #선화 #역화 #블루오프
'위험물 기능장 > 위험물의 성질 및 취급' 카테고리의 다른 글
| 제2류 위험물 - 가연성 고체 (0) | 2025.01.05 |
|---|---|
| 무수물, 무수산화물 / anhydride / 無水物 (0) | 2025.01.02 |
| 위험물 및 지정수량 (2) | 2025.01.01 |
| 연소생성물과 특성, 열 · 연기의 유동특성 (4) | 2025.01.01 |
| 발화, 폭발 - 위험물의 연소 특성 (2) | 2025.01.01 |
