1. 공유결합
가. 공유결합이란 ?
원자들이 각각 전자를 내 놓아 전자쌍을 만들고, 이 전자쌍을 공유함으로써 형성되는
결합으로 오비탈의 겹침에 의해 원자 핵 사이에 전자밀도가 집중되어 형성된다.
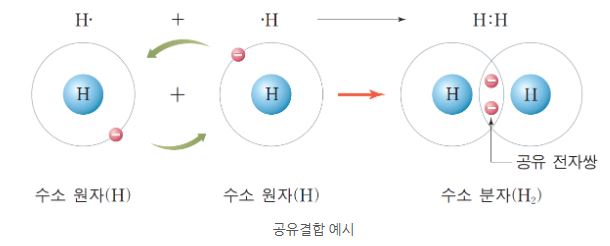
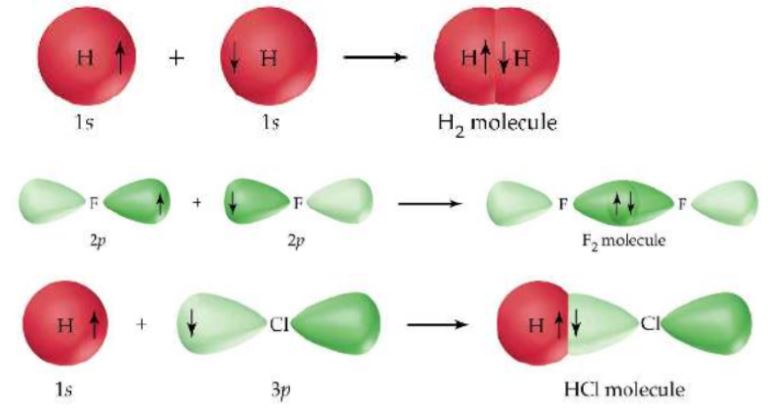
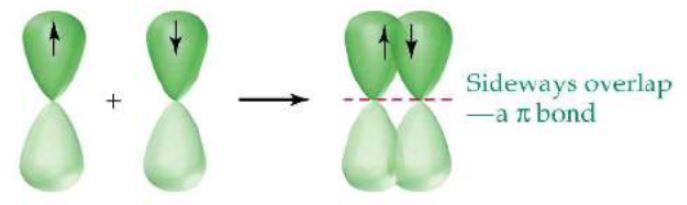
공유결합은 원자 오비탈 겹침에 의하여 형성되고 각 오비탈은 반대 스핀의 한쌍의 전자
를 포함한다. 이 때 각 결합한 원자의 오비탈은 그 상태를 유지하되 겹침 오비탈의 전자쌍
은 두 원자에 의하여 공유한다.
시그마 결합 (σ)
파이 결합 (π)
2. 원자가 결합 이론 (Valence Bond Theory, VBT)의 한계
가. 원자가 결합이론이란 ?
화학결합이 두 원자들 사이에 편재된 한 쌍의 전자로 표현되는 Lewis 전자쌍 모형을 설명하기 위한 이론 중 하나이다.
① 화학결합에 최외각의 전자들만 참여한다.
② 공유결합을 이루기 위해서는 원자에 전자 한개가 들어 있는 오비탈이 있어야 한다.
이 조건을 충족시키는 원자 두개가 접근하면 두개의 오비탈이 겹쳐지고, 겹쳐진 오비탈에 각 전자 한 개씩, 총 2개가
같이 들어 있으면서 양 쪽의 핵을 묶어주는 공유결합을 이룬다.
③ 분자 안에서 각 전자는 원자 궤도함수에 존재하고 분자내 결합은 원자가 전자들의 원자궤도함수가 최대로 겹치면서
반발력이 최소화되는 거리에서 이루어진다.
나. 한계
① 자기성 예측이 불명확
O2 분자는 상자기성을 띤다. 하지만 위 VBT 이론상 SP2 혼성궤도함수를 가지는 반자기성 분자이어야 한다.
② 분자의 전자가 원자에 속한다고 설명
H + H → H2 에서 전자 2개를 나눌 수 있다고 설명하지만, 실제로는 나눌 수 없다.
③ 결합에너지 설명이 어려움
O2 와 O2+ 중 어느 분자의 결합에너지가 큰지 예측이 불가능하다.
#공유결합 #오비탈 #원자가 #Lewis #원자가결합 #전자쌍 #최외각 #전자 #스핀
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 혼성 오비탈 (Hybrid Orbital) (2) | 2024.12.26 |
|---|---|
| 화학결합 - 공명구조, 형식전하, 옥텍규칙 예외, 확장 (0) | 2024.12.24 |
| 위험물 기능장 제1~6류 위험물 시성식 총정리 (0) | 2024.12.23 |
| 방향족 탄화수소와 유도체 (6) | 2024.12.22 |
| 볼프강 파울리 (Wolfgang Pauli)의 배타원리 (0) | 2024.12.22 |
