1. 벤젠의 유도체들
벤젠 유도체는 대부분 벤젠에 달려 있는 수소 1개 또는 2개, 혹은 그 이상을 작용기로 치환
한 물질이다. 벤젠 유도체는 다양하지만 그 중 다음 것들을 기억해 두자.
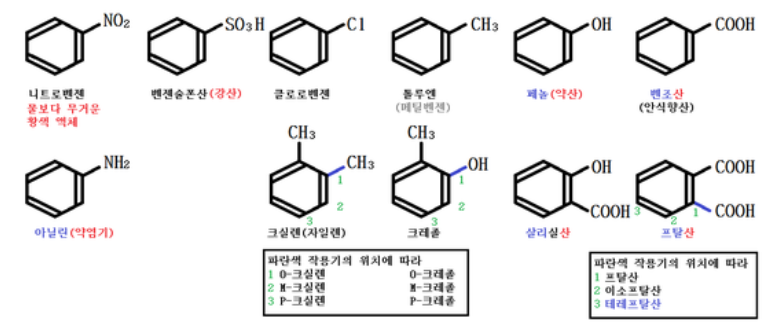
가. 니트로 벤젠
⊙ 물 보다 밀도가 크다.
⊙ 담황색 액체이다.
나. 벤젠 술폰산
⊙ 강산이다.
다. 클로로 벤젠
라. 톨루엔
⊙ 산화하면 벤조산이 된다. (과망간산 칼륨 등을 이용)
마. 페놀
⊙ 리트머스지에 검출되지 않을 정도로 약한 산이다.
⊙ 염화철 (FeCl3 (간혹 FeCl2))과 반응하여 보라색(청색)을 띤다. (정색 반응)
바. 벤조산 (안식향산)
⊙ 카르복시산이다.
사. 아닐린
⊙ 약 염기성이다.
⊙ 벤젠 유도체 중 희귀한 염기성 물질이다.
아. 크실렌
⊙ 산화하면 프탈산이 된다.
자. 크레졸
⊙ 페놀의 성질을 나타낸다. (약산, 정색반응)
차. 살리실산
⊙ 무색의 바늘 모양 결정
⊙ 카르복시산이다.
⊙ 페놀의 성질과 카르복시산의 성질을 모두 나타낸다.
⊙ 이성질체가 존재하지만 이 모양만 살리실산이라 한다.
카. 프탈산
⊙ 카르복시산이다.
<참고>
벤젠의 화학식은 C6H6이다.
벤젠의 화학식은 C에 비해 다른 원자가 유달리 적다.
이런 특이한 구조를 가진 물질은 벤젠 이외에는 거의 없다.
이를 응용하여 C가 6개 이상이고 H (혹은 다른 원자)가 유난히 적은 경우에는 이 구조식에는 벤젠 고리가 존재한다고 보면 된다.
이 때 벤젠의 치환기 1개 일 때는 C6H5, 2개 일 때는 C6H4 을 기본으로 하고 치환기를 생각하면 된다.
2. 벤젠 유도체
가. 벤젠의 치환반응
방향족(벤젠) 화합물에서 가장 중시해야 할 내용은 제법과 각 물질의 성질이다.
그 중에서 벤젠 유도체의 가장 간단한 제법인 치환반응을 알아 보자.
일반적인 벤젠의 치환반응은 다음과 같이 진행된다.
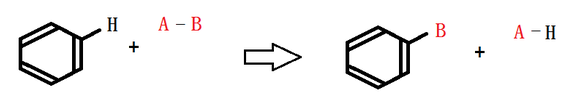
위 그림의 치환방식을 이용하여 각각의 물질에 적용해 보자.
① 니트로화 (벤젠 + 질산 → 니트로벤젠 + 물)

니트로 벤젠은 황색 액체이다.
② 술폰화(설폰화) (벤젠 + 진한황산 → 벤젠 술폰산 + 물)

③ 할로겐화 (벤젠 + 할로겐 → 할로겐화 벤젠 + 할로겐산)

염소만 치환되는게 아니고 브롬 등 다른 할로겐 물질로 치환이 가능하다.
④ 알킬화

R에는 여러 알킬기가 올 수 있다. 메틸기가 오면 톨루엔의 제법이 된다.
⑤ 그밖의 치환기
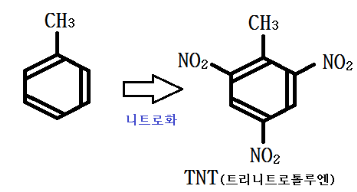
벤젠이 아닌 벤젠의 치환체에 니트로화하는 경우이다.
벤젠의 치환의 경우 O-, p- 위치 (2,4,6)에 붙는다.
㉠ TNT 제법
㉡ 피크린산 제법
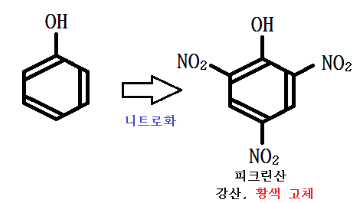
⊙ 피크린산은 강산이며 황색 고체이다.
나. 벤젠의 첨가 반응
벤젠의 경우 첨가 반응을 거의 하지 않지만 촉매 (Pt, Ni)를 가하거나 자외선과 같은 강한 빛을 쏴 주면 첨가반응을 하게
된다.
첨가반응은 거의 대부분 아래 그림의 2가지 경우이다.
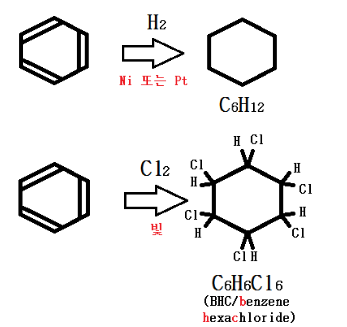
이들 생성물은 탄소가 동일 평면에 있지 않다는 특징이 있다.
3. 주요 벤젠 유도체
가. 페놀
가장 간단한 벤젠 유도체 이다.
가장 특성도 많고 볼 것도 많으며 중간 과정도 많은 벤젠 유도체이다.
<페놀의 제법>
제법은 3개나 되고 복잡하지만 반드시 알아 두자.
① 쿠멘법
쿠멘 (이소프로필 벤젠)의 중간 과정을 거치는 제법이다.
아세톤을 부산물로 얻을 수 있다.
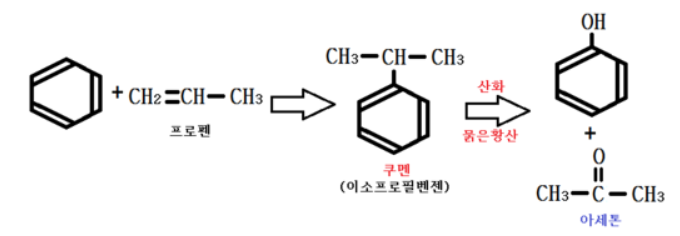
쿠멘은 C9H12와 같이 나오는 경우도 있다.
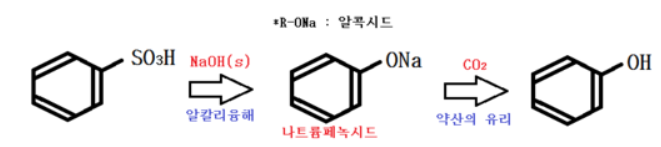
② 벤젠 술폰산의 알칼리 융해
알칼리 융해란 여러가지 유기화합물을 고체의 수산화 알칼리와 함께 가열 · 유해하여 변화시키는 과정을 말한다.
여기서는 고체 NaOH를 이용한 알칼리 융해를 통해 나트륨 페녹시드를 얻고 이산화탄소를 가해
약산인 페놀을 유리시킨다.
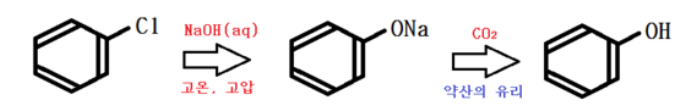
③ 클로로 벤젠 이용
클로로 벤젠을 NaOH 수용액에서 고온, 고압을 통해 나트륨 페녹시드를 얻고 이산화탄소를 가해
약산인 페놀을 유리시킨다.
[페놀의 성질]
⊙ 약산이다.
⊙ 알코올이다.
⊙ 알코올이지만 산이므로 NaOH와 반응을 한다.
⊙ Na와 반응을 한다.
⊙ 검출반응 : 염화철 (FeCl3 혹은 FeCl2)과 반응하여 보라색 (혹은 청색 계열)을 나타낸다.
염화철의 정색반응이라고 한다. (정색반응은 색을 나타내는 반응을 통털어 나타내는 말이다.)
⊙ 페놀 이외에도 벤젠 고리에 OH가 직접 붙은 화합물과 나트륨 페녹시드는 염화철과 정색반응을 한다.
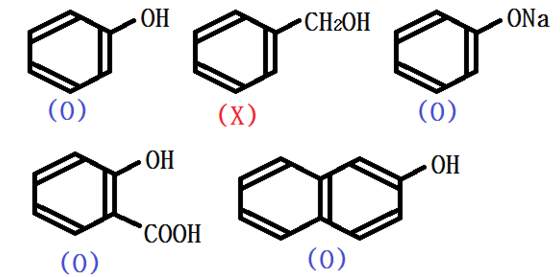
나. 벤조산 (안식향산), 프탈산
① 벤조산 : 알킬벤젠의 산화
② 프탈산 : 디알킬 벤젠의 산화
라고 할 수 있는데 아래 그림과 같다.
① 벤조산
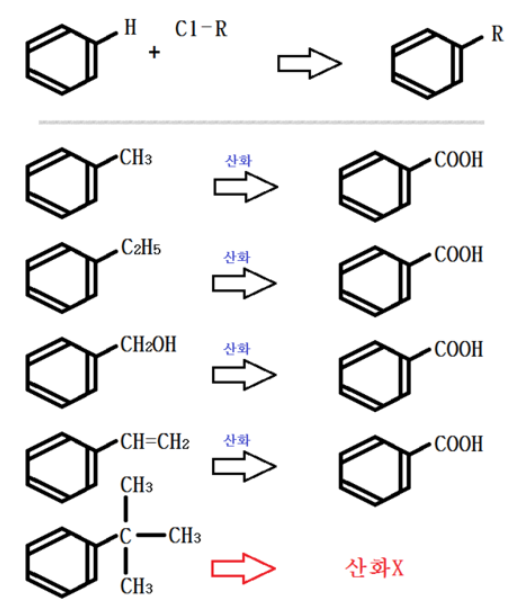
일반적으로 벤젠에 C가 직접 붙으면 대부분 산화 (KMnO4 등 이용)하면 벤조산이 된다.
그런데 알코올과 마찬가지로 벤젠 고리에 붙은 C에 직접 연결된 H가 없는 경우에서는 산화가 불가능하다. 벤조산은 카르복시산이다.
② 프탈산
프탈산의 경우 치환기가 2개 이므로 프탈산 (O- 프탈산), 이소프탈산 (m-프탈산),
테레프탈산(p-프탈산) 3가지 이성질체가 존재한다. 제법은 벤조산과 비슷하나 크실렌을
사용하는 것에 차이가 있다.
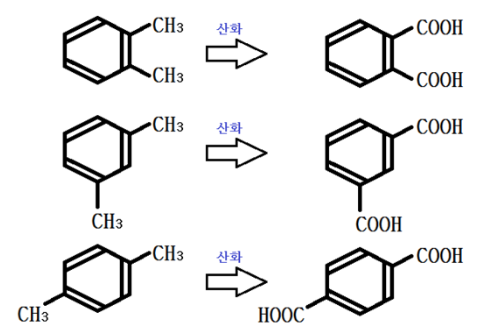
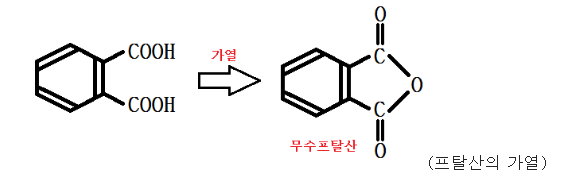
공통 : 디카르복시산
프탈산 : 가열시 무수물을 만듬 (무수프탈산)
이소프탈산
테레프탈산 : 축합 중합의 원료 (페트병의 원료, 에틸렌 글리콜과 중합)
3. 살리실산
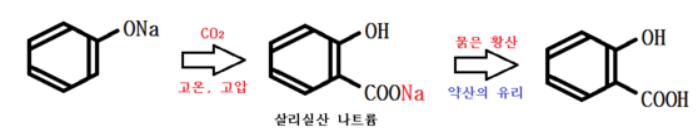
고온, 고압을 가하지 않으면 페놀의 제법과 같다. 살리실산 나트륨에서 Na가 COOH 쪽에만 붙은 것은 COOH가 페놀 보다 더 강한 산이다.
살리실산의 성질은 다음과 같다.
⊙ 페놀의 성질과 카르복시산의 성질을 둘 다 나타낸다.
⊙ 산의 세기는 카르복시산을 띤다.
⊙ 무색 바늘 모양의 결정
⊙ 염화철과 정색 반응
살리실산은 닉값을 좀 해서 약용으로 쓰는 아세틸살리실산과 살리실산메틸의 재료가 된다.
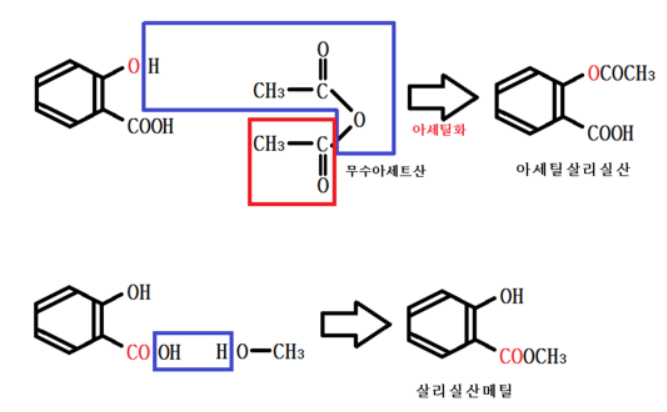
<아세틸 살리실산>
⊙ 아세트산을 무수아세트산을 이용해 아세틸화
⊙ OH가 없으므로 염화철과 정색반응을 하지 않음
⊙ 무색 바늘 모양 결정
⊙ 아스피린 (해열, 진통)
<살리실산 메틸>
⊙ 메탄올과 물 분자 하나가 빠져 나오면서 결합
⊙ OH가 있으므로 염화철과 정색 반응
⊙ 카르복시산은 아님
⊙ 파스 (소염, 진통)
4. 방향족 아민
방향족 아민은 벤젠 고리에 NH2가 붙은 유기화합물이다.
아미노기가 붙어 있는 방향족 아민은 염기성을 나타낸다.
가. 아닐린의 제법과 성질
아닐린 니트로벤젠을 Sn으로 환원시켜 만든다.
주석을 환원제로 사용하는 가장 대표적인 사례가 아닐린 제법이다.
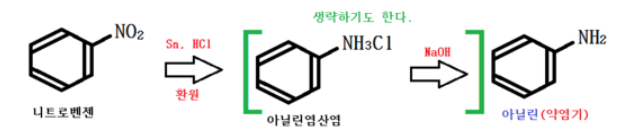
<아닐린의 성질>
⊙ 염기성이다.
⊙ 검출반응 1. 표백분과 보라색으로 정색 반응
⊙ 검출반응 2. K2Cr2O7 로 산화 (아닐린 블랙)
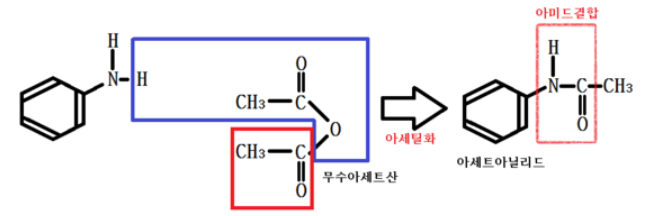
아닐린은 아세틸화하면 아세트아닐리드 라는 물질이 되며 해열, 진통제로 쓰인다.
나. 아조 화합물
아조기 : - N = N -
디아조늄 이온 : R - N+ ≡ N
① 디아조화
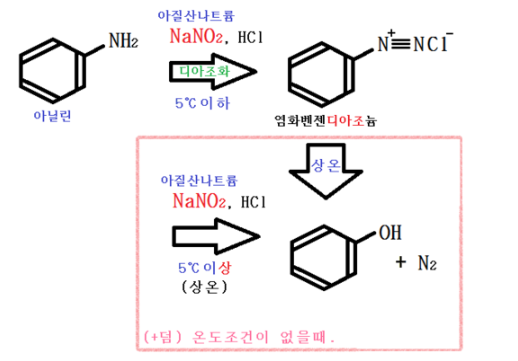
디아조화이므로 3중 결합을 한다.
② 아조 커플링 (디아조커플링, 커플링)
위 반응과 이어진 것이다. 디아조늄화합물 + 방향족 화합물에서 아조화합물이 되는 반응을 커플링이라고 한다.
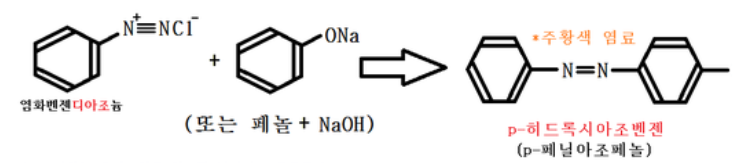
가장 대표적인 파라히드록시 아조벤젠의 제법이다. 삼중결합이 아니고 이중결합이라는 점을 명심하자.
5. 유기혼합물의 분리
유기혼합물의 분리는 대부분 벤젠 유도체의 분리가 대부분을 차지한다.
주요형태는 다음과 같다.
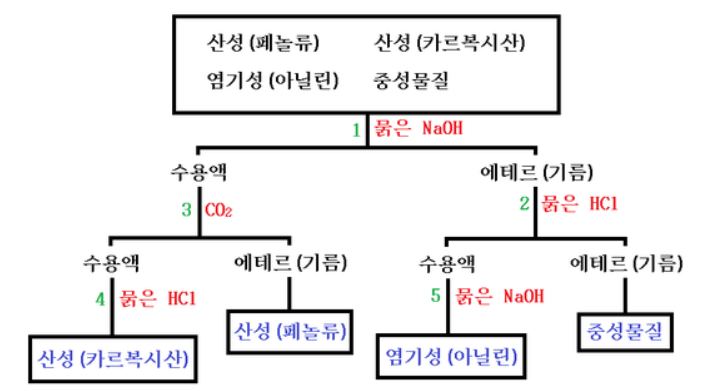
위 그림의 과정을 이해해 보자.
0. 물질들을 미리 기준으로 나누자.
① 페놀류 : 페놀, 살리실산 메틸
② 카르복시산 : 벤조산 (안식향산), 살리실산, 아세틸살리실산
③ 염기성 : 아닐린
④ 중성물질 : 나머지 (벤젠, 나프탈렌, 톨루엔, 니트로벤젠 등)
1. 묽은 NaOH (혹은 다른 강염기)를 넣는다.
이 과정은 산성인 물질을 염으로 만드는 것이므로 이 반응으로 수용액이 만들어 진다.
이 때 페놀과 벤조산을 바로 쓰지 않고 그 염인 나트륨페녹시드와 벤조산나트륨을 쓴다.
2. 에테르층에 HCl을 가한다.
이 과정에서 염기성인 아닐린이 아닐린염산염으로 변해 수층으로 녹아 나온다.
에트르층에 남아 있는 것은 벤젠이다.
이 아닐린산 염을 가지고 5. 묽은 NaOH를 가해서 약염기의 유리를 이용해 (약산의 유리와 비슷함) 아닐린을 얻어 낸다.
3. 산의 염이 있는 수용액층에 이산화탄소를 가한다.
[R-COOH > 탄산, 이산화탄소 > 페놀]을 이용하는 것이다.
페놀은 탄산보다 약산이므로 유리되어서 에테르에 녹아 나오며 카르복시산인 벤조산나트륨은 그대로 염의 상태로 수용액에 녹아 있다. 이 벤조산나트륨을 마지막으로 4. 묽은 염산을 가해 유리시켜 벤조산을 만든다.
이렇게 하여 4가지 물질을 원래 형태로 각각 분리해 낼 수 있다.
#방향족 #유기화합물 #벤젠 #유도체 #페놀 #톨루엔 #벤조산 #살리실산 #프탈산 #클실렌 #니트로벤젠 #벤젠술폰산
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 공유결합, 원자가결합이론 (VBT)의 한계 (0) | 2024.12.24 |
|---|---|
| 위험물 기능장 제1~6류 위험물 시성식 총정리 (0) | 2024.12.23 |
| 볼프강 파울리 (Wolfgang Pauli)의 배타원리 (0) | 2024.12.22 |
| 화학평형상수 k값 계산하기.. (0) | 2024.12.21 |
| 화학반응과 반응열 - 헤스의 법칙 (4) | 2024.12.17 |
