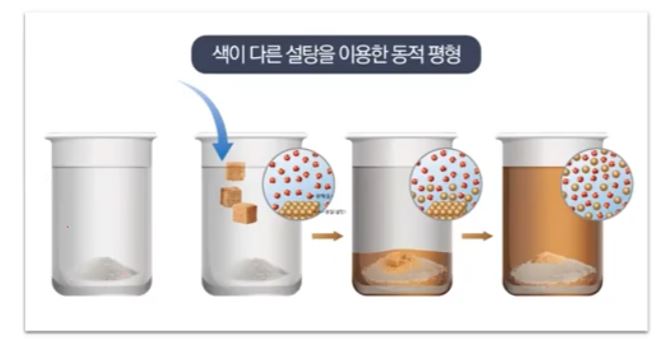
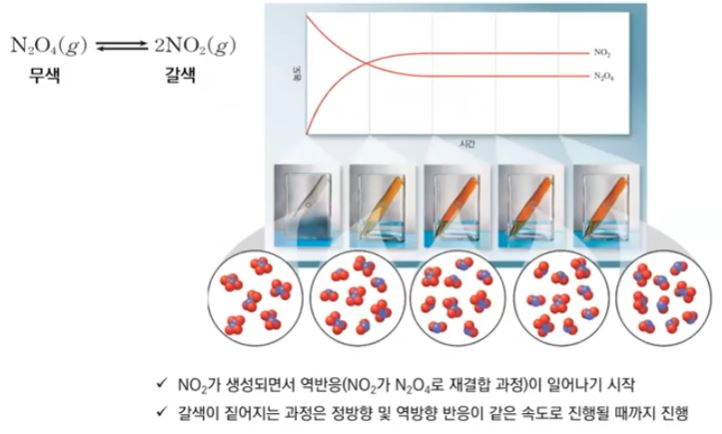
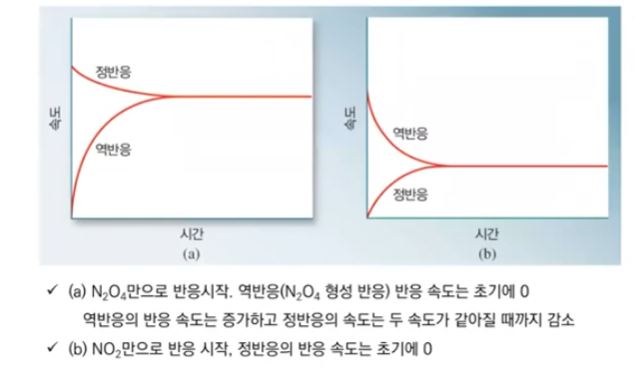
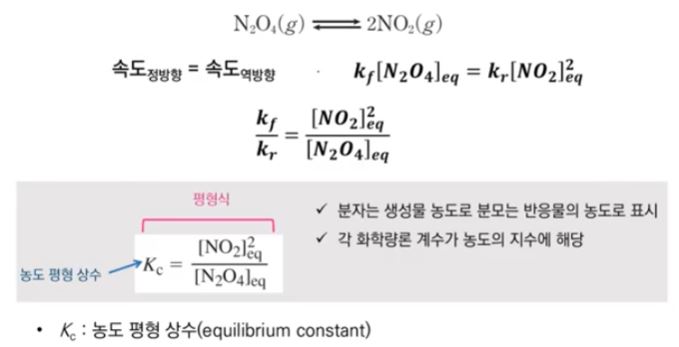
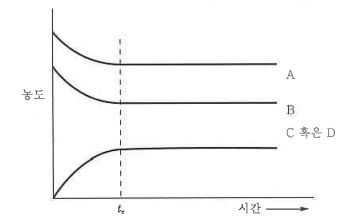
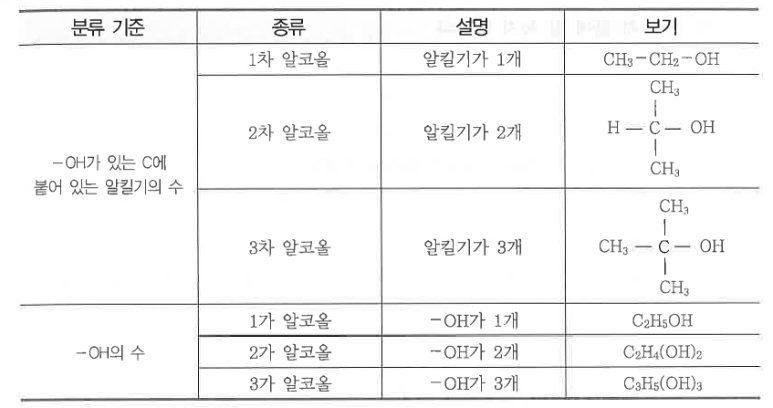
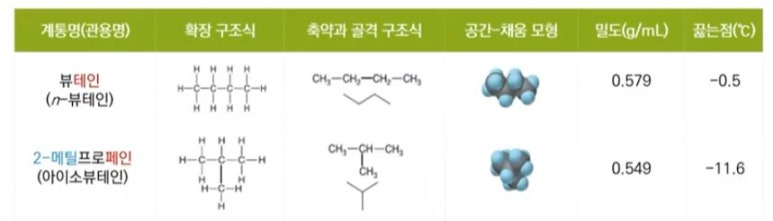
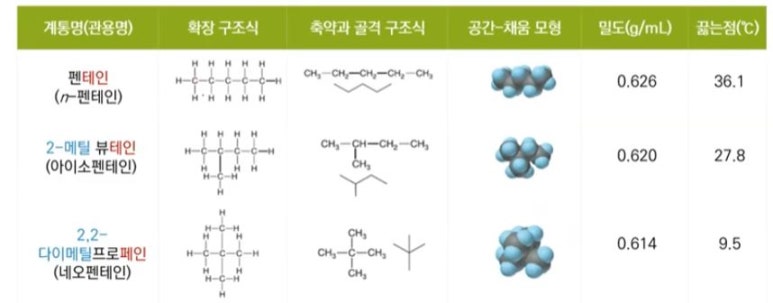
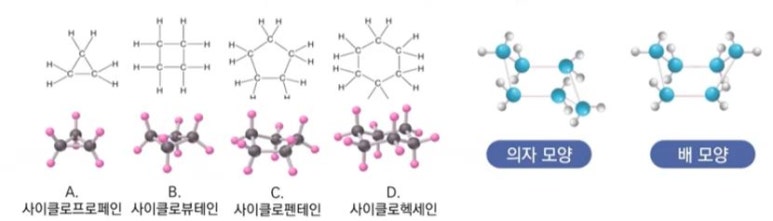
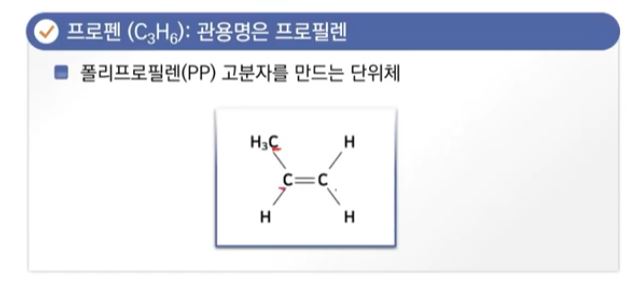
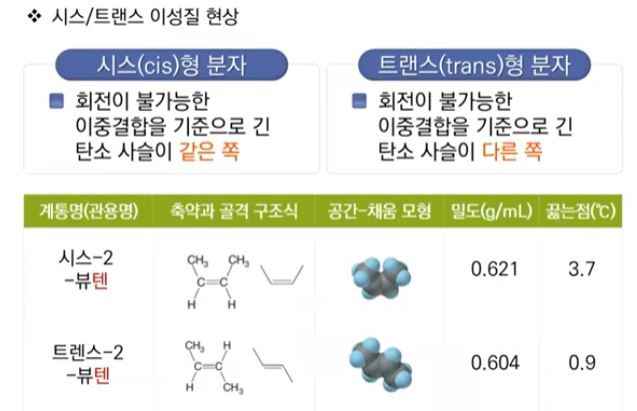
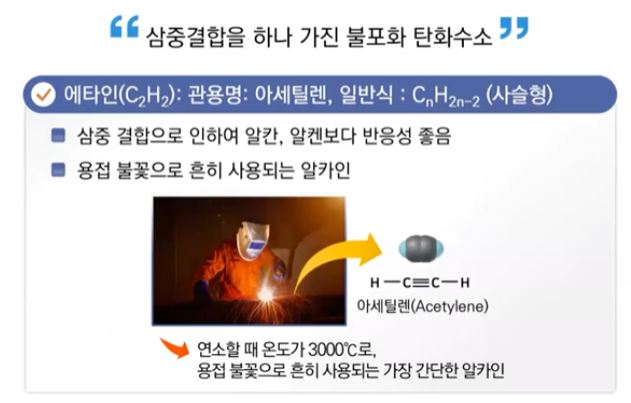
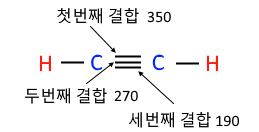
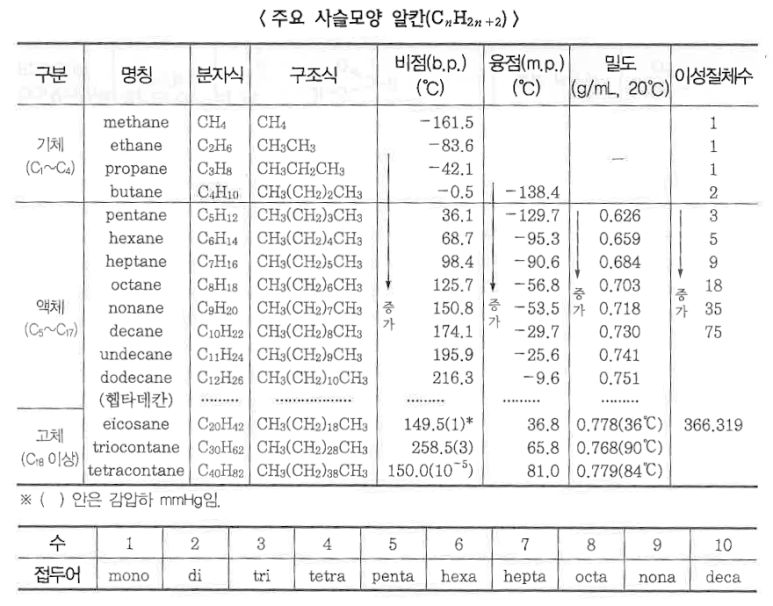
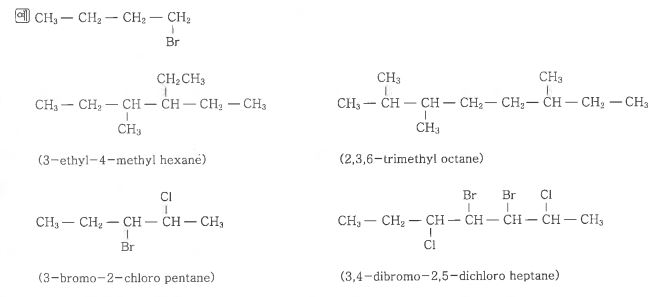
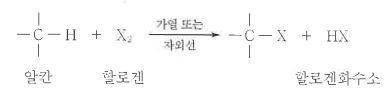
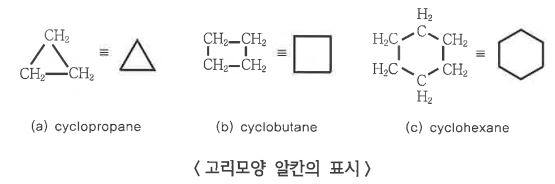
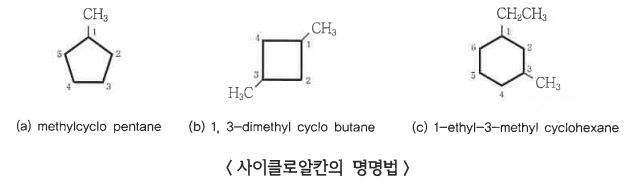
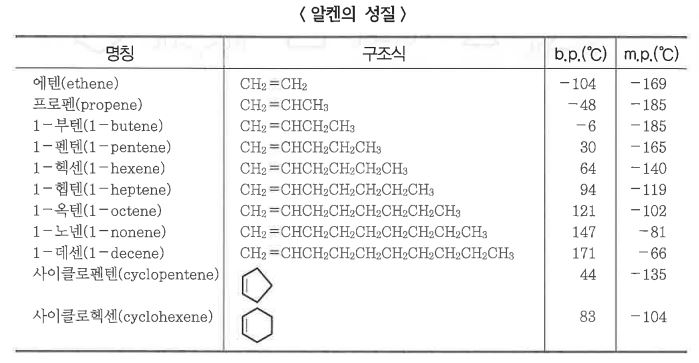
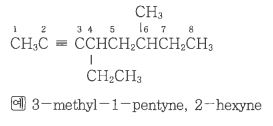
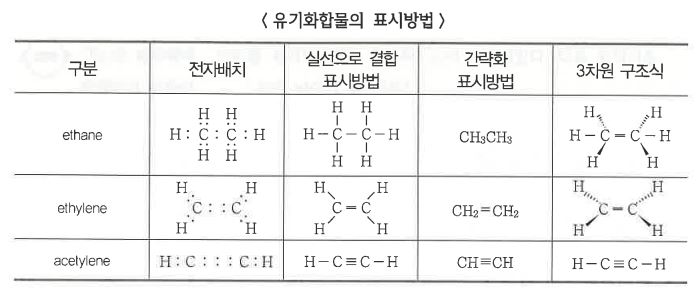
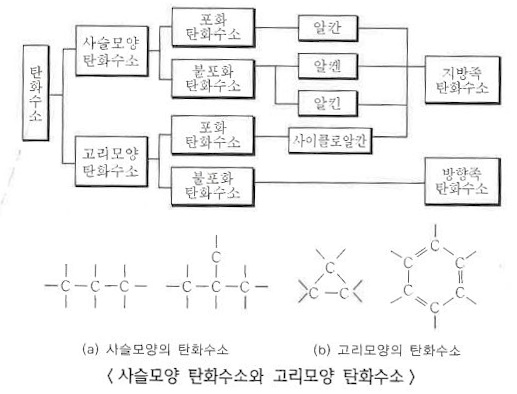
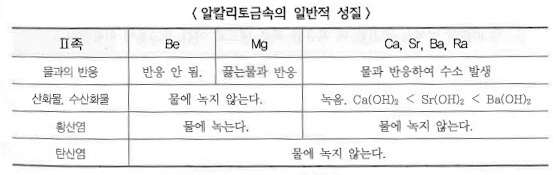
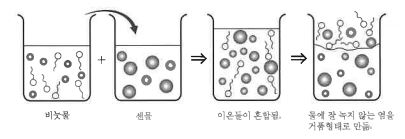
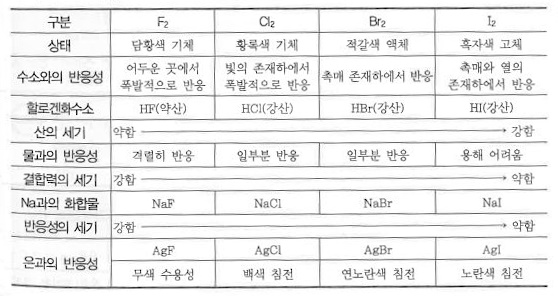
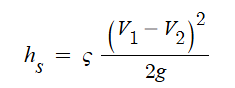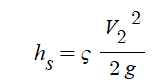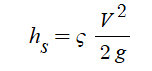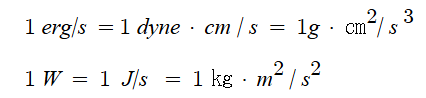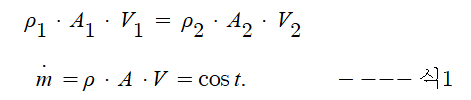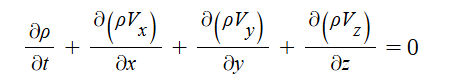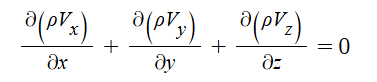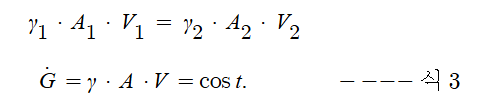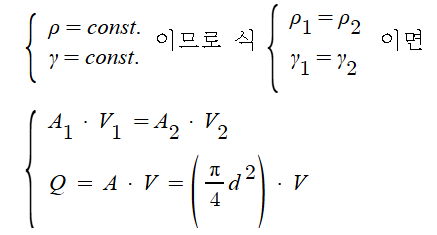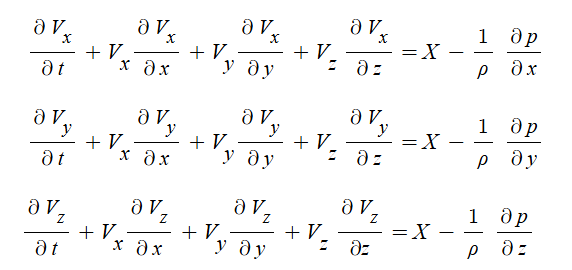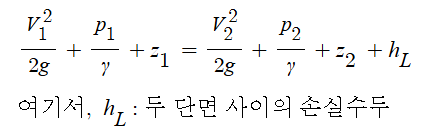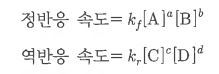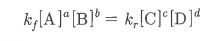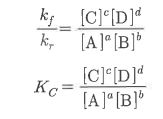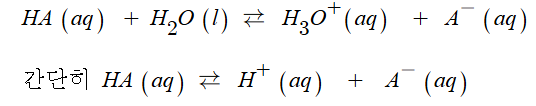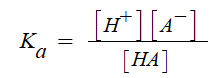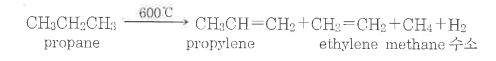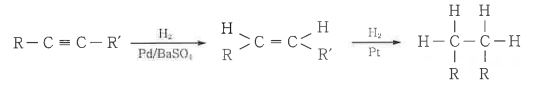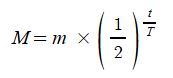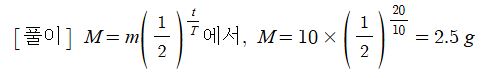1. 펌프의 분류
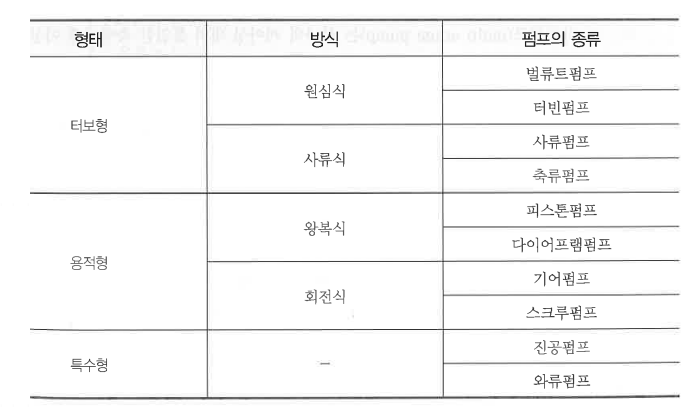
가. 원심펌프 (Centrifugal pump)
▣ 원심펌프는 Vane (Blade)이 달린 임펠러 (Impeller)가 밀폐된 케이싱 (Casing)내에서 회전함으로써 발생하는 원심력을
이용하여 비압축성 유체를 이송하거나 압력을 높여 주는 회전기기이다.
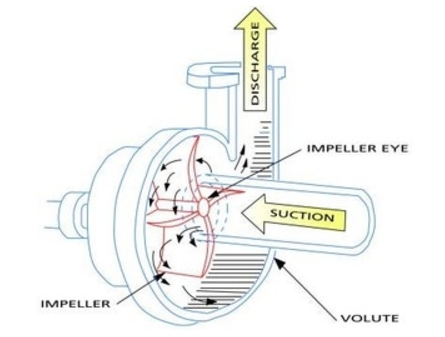
▣ 원심펌프에서 유체를 이동시키는 원력력은 압력이다.
<원심펌프의 원리>
① 유체는 Impeller 중심에서 강제로 유입된다.
② 베인 (Vane)을 따라 반지름 방향으로 흐르는 사이에 유체는 운동에너지를 얻는다.
③ 유체가 볼류트 (Volute)를 통과하는 사이에 운동에너지가 압력에너지로 변환된다.
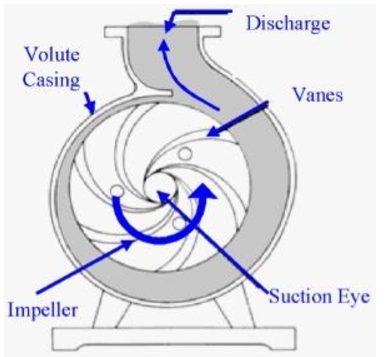
▣ 회전차 (Impeller)의 회전운동에 의하여 발생하는 원심력 (centrifugal force)을 이용하여 가압하는
펌프를 말한다.
① 원심펌프의 종류
㉮ 안내날개 유무에 따른 분류
㉠ 벌류트 (volute) 펌프는 회전차의 형상이 벌류트형으로 되어 있는 펌프로 안내날개가 없는 펌프이다.
벌류트 펌프는 주로 양정이 낮고 양수량이 많은 곳에서 사용한다.
※ volute : [건축] 소용돌이꼴 ((주두(柱頭)·제단의 난간의 장식 등, 특히 이오니아 및 코린트식))
고둥의 일종
㉡ 터빈펌프 (turbin pump) : 회전차의 형상이 터빈형으로 되어 있으며, 안내날개가 있는 펌프이다.
터빈 펌프는 양정이 높고, 방출압력이 높은 곳에서 사용된다.
㉯ 흡입 방식에 의한 분류
㉠ 단흡입펌프 (single suction pump) : 회전차의 한쪽에서만 유체를 흡입하는 펌프이다.
㉡ 양흡입펌프 (double suction pump) : 회전차의 양쪽에서 유체를 흡입하는 펌프이다.
㉰ 회전차의 개수에 의한 분류
㉠ 단단펌프 (single stage pump) : 하나의 케이싱 내에 1개의 회전차로 구성된 펌프이다.
㉡ 다단펌프 (multi-stage pump) : 하나의 케이싱 내에 동일한 축에 2개 이상의 회전차를 직렬로 배치한 펌프이다.
㉱ 축의 형상에 의한 분류
㉠ 횡축식 펌프 (horizontal type pump) : 펌프의 주축이 수평으로 설치된 펌프로 대다수의 펌프가 횡축식 형태를
가진다.
㉡ 종축식 펌프 (vertical type pump) : 주축이 수직으로 설치된 펌프로 공동현상의 발생이 우려되는 곳에 설치한다.
㉢ 사류 펌프 : 회전차의 형상이 프로펠러형으로 되어 있으며, 오물을 양수하기에 용이하게 회전날개가 칼날과 같이
절단할 수 있게 되어 있는 펌프이다.
㉣ 축류 펌프 : 회전차의 형상이 나사모양의 스크루와 같은 형상으로 되어 있는 펌프이다.
나. 축류 펌프
▣ 축류 펌프(軸流-, axial-flow pump, AFP)는 프로펠러형 날개를 회전시켜 액체를 축방향으로 보내는 펌프이다.
날개의 각도를 바꿈으로써 넓은 양정범위(揚程範圍)로 효율적으로 사용할수 있다. 이것은 카플란수차와 대응될
수 있다. 축류 펌프의 주된 장점은 상대적으로 낮은 수직 거리에 상대적으로 높은 배출(유속)이다.

▣ 축류 펌프는 다수 (보통 3~5)의 깃을 가진 회전차를 동력장치에 직접 연결하여 작은 용량으로 큰 유량을 수송할 수
있게 설계된 펌프이다.
다. 왕복펌프 (Reciprocating pump)
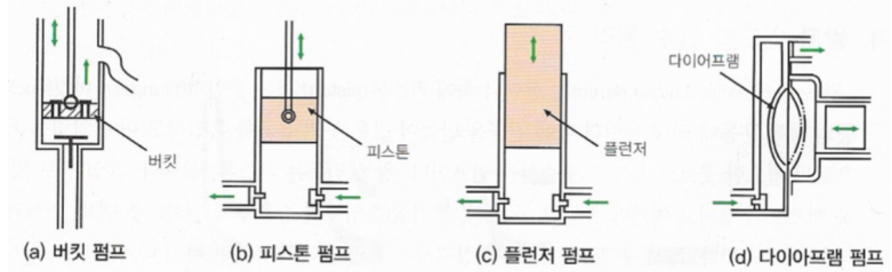
▣ 왕복펌프는 펌프를 구성하고 있는 피스톤 등의 왕복운동에 의해 실린더 내를 진공에 가까운 압력상태로 만들어 낮은
곳에 있는 물을 흡입하고 여기에 압력을 가하여 필요한 거리로 수송하는 설비를 말한다.
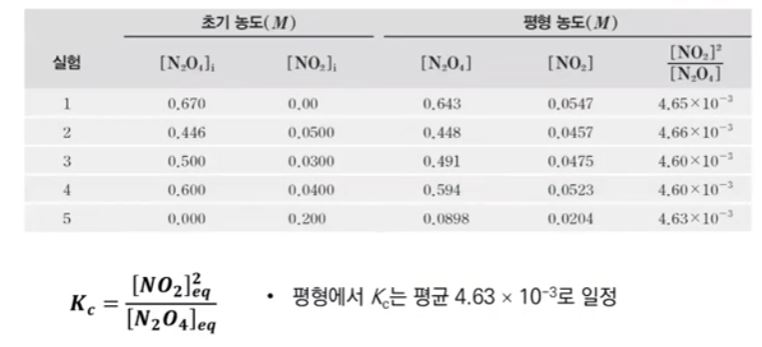
2. 펌프의 양정 및 동력
▣ 펌프의 전양정 = 흡입양정 + 토출양정 + 관내 마찰손실수도
⊙ 펌프의 실양정 = 흡입양정 + 토출양정
가. 펌프 양정의 구성
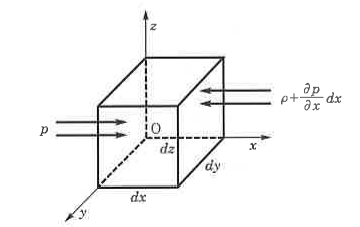
① Weisbach - Darcy의 마찰손실 공식

여기서, △h : 배관의 마찰손실수두 (mAq), f : 관의 마찰손실계수
L : 배관의 길이 (m) U : 유속 [m/sec] D : 배관의 직경 [m] g : 중력가속도 (9.81 m/sec2)
∴ 압력손실수두 : P = γh 를 적용시키면

② 하젠 - 윌리암스의 식

여기서, △P : 마찰손실압력 (kgf / ㎠), Q : 유량 (ℓ/min, lpm), D : 관경 [㎜]
L : 배관의 길이 (linear 및 상당길이의 합), C : 관벽의 조도에 의한 계수
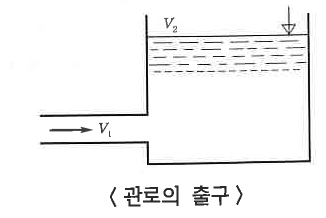
③ 흐름에서의 미소손실 : 관이 휘어지거나 관의 중간에 엘보(elbow), 조인트 (joint), 밸브 (valve) 등과 같은 부속들을 사용
하여 관에서의 단면의 형태가 변화되는 곳에서 발생하는 손실을 미소손실이라고 한다. 미소손실에 의한 손실
수두 HL은 다음과 같다.

여기서, HL : 손실수두, K : 미소손실수두계수, U2/(2g) : 속도수두
나. 펌프 소요동력의 산출
▣ 힘(F)은 질량(m)에 가속도(g)가 가해진 값이며, 일(W)은 힘(F)에 거리 변화가 발생한 값과 같다.
또한 동력은 일(W)을 시간으로 나눈 값과 같은 의미를 가진다.
그러므로 유체를 수송하는 펌프의 동력값에 대해 살펴보면 다음과 같이 나타낼 수 있다.

▣ 펌프의 효율이 η이고 축동력 전달계수를 K라고 하면 펌프의 동력값은 다음과 같다.

여기서, P : 동력(kW), Q : 정격 토출량 (㎥/min), H : 양정 (유체 이송 높이) [m]
η : 펌프의 효율, K : 축동력 전달계수 (보통 1.1을 사용)
3. 펌프에서 발생하는 현상
가. 공동현상 (cavitation)
▣ 액체 속을 고속도로 움직이는 물체의 표면은 액체의 압력이 저하하는데, 이 때의 압력이 액체의 포화 증기압 보다 낮아
진 범위에 증기가 발생하거나 액체 속에 녹아 있던 기체가 나와서 공동현상을 이룬다.
이것은 수력터빈이나 선박용 프로펠러를 운전할 때 자주 발생하는 현상으로 압력 면에 발생하는 경우도 있지만,
주로 날개의 등 부분에 발생한다. 발생한 기포는 압력이 높은 부분에 이루면 급격히 부서져 소음이나 진동의 원인이
되며, 터빈이나 프로펠러의 효율을 떨어뜨린다.
① 발생원인
㉠ 펌프 임펠러 깃에서 물의 압력이 포화증기압 이하로 내려가면 증발하여 기포가 발생한다.
㉡ 펌프의 흡입측 낙차가 클 경우
㉢ 이송하는 유체가 고온일 경우
㉣ 펌프의 마찰손실이 클 경우
㉤ 임펠러 속도가 지나치게 클 경우
② 발생현상
㉠ 소음과 진동이 발생한다.
㉡ 펌프의 성능 (토출량, 양정, 효율)이 감소한다.
㉢ 임펠러 (Impeller)의 침식이 발생한다.
㉣ 심하면 양수불능상태가 된다.
③ 방지대책
㉠ 펌프 내에서 포화증기압 이하의 부분이 발생하지 않도록 조치한다.
㉡ 펌프의 설치위치는 가능한 낮게 한다.
㉢ 펌프의 회전수를 낮추고, 흡입 비속도를 크게 한다.
㉣ 펌프의 마찰손실을 작게 한다.
㉤ 펌프의 유량을 줄이고 양흡입펌프를 사용한다.
나. 수격 작용 (Water hammering)
▣ 관 내를 흐르고 있는 물의 유속이 바뀌면 유체의 운동에너지가 압력에너지로 변하여 관내 압력이 상승하게 되어 배관
과 펌프에 손상을 주는 현상으로 수격작용은 펌프의 운전중은 물론이고 펌프가 정지될 때도 발생할 수 있으므로 대용
량인 펌프와 배관이 길어지는 경우에는 적절한 대비책이 있어야 한다.
① 발생원인
㉠ 정전 등으로 갑자기 펌프가 정지할 경우
㉡ 밸브를 급히 개폐할 경우
㉢ 펌프의 정상운전시 유체의 압력 변동이 있는 경우
② 발생현상
㉠ 압력상승에 의해 펌프, 밸브, 플랜지, 관로 등 여러 기기가 파손된다.
㉡ 압력강하에 의해 관로가 압괴하거나 수주분리가 생겨 재결합시에 발생하는 격심한 충격파에 의해 관로가 파손된다.
㉢ 소음과 진동의 원인이 된다.
㉣ 주기적인 압력변동 때문에 자동제어계 등 압력을 컨트롤하는 기기들이 난조를 일으킨다.
③ 방지대책
㉠ 관경을 굵게 하여 가능한 한 유속을 느리게 한다.
㉡ 펌프 회전축에 플라이휠(Flywheel)을 설치하여 펌프의 급속한 속도변화를 방지한다.
㉢ 펌프의 토출측에 조압수조(Surge tank) 또는 수격 방지기(water hammering cusion)를 설치한다.
㉣ 유량조절 밸브를 펌프 토출측 직후에 설치하고 적당한 밸브 제어를 한다.
다. 맥동현상 (Surgeing)
▣ 펌프의 운전중에 압력계기의 눈금이 어떤 주기를 가지고 큰 진폭으로 흔들림과 동시에 토출량은 어떤 범위에서 주기적
으로 변동이 발생하고 흡입 및 토출 배관의 주기적인 진동과 소음을 수반한다. 이를 맥동(Surging)현상이라 한다.
① 발생원인
㉠ 펌프의 H - Q 곡선이 오른쪽 상승부에서 운전 시
㉡ 펌프의 토출관로가 길고, 배관 중간에 수조 또는 기체가 존재 시
㉢ 수조 또는 기체상태가 잇는 부분의 하류측 밸브에서 토출량을 조절 시
② 발생현상
㉠ 흡입 및 토출 배관에 주기적인 진동과 소음이 발생한다.
㉡ 한번 발생하면 그 변동주기는 비교적 일정하고, 송출밸브로 송출량을 조작하여 인위적으로 운전상태를 바꾸지 않는
한 이 상태가 지속된다.
③ 방지대책
㉠ 펌프의 H - Q 곡선에 오른쪽 하향구배 특성을 가진 펌프를 채용한다.
㉡ 회전차나 안내깃의 형상 치수를 바꾸어 그 특성을 변화시킨다.
㉢ 바이패스관을 사용하여 운전점이 펌프 H-Q 곡선의 오른쪽 하향구비 특성 범위 위치에 오도록 한다.
㉣ 배관 중간에 수조 또는 기체 상태인 부분이 존재하지 않도록 배관한다.
㉤ 유량조절밸브를 펌프 토출측 직후에 위치시킨다.
㉥ 불필요한 공기탱크나 잔류공기를 제어하고, 관로의 단면적, 유속, 저항 등을 바꾼다.
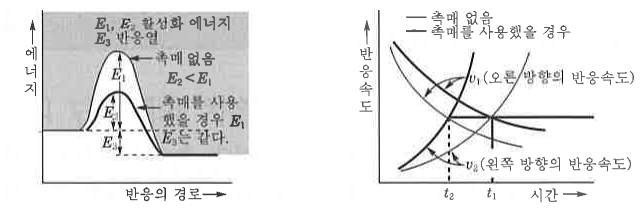
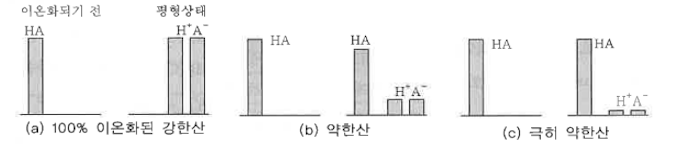
#펌프 #양정 #캐비테이션 #공동현상 #수격현상 #맥동현상 #마찰손실계수 #다르시 #하젠 #윌리암스
#펌프출력 #안내깃 #임펠러
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 당량 : 당량은 화학반응으로 결정된다. (2) | 2024.11.24 |
|---|---|
| 퍼센트 농도, 몰 농도, 노르말 농도 (0) | 2024.11.24 |
| 배관 이송 설비 (0) | 2024.11.22 |
| 유체역학 기초 이론 (단위와 차원) (4) | 2024.11.22 |
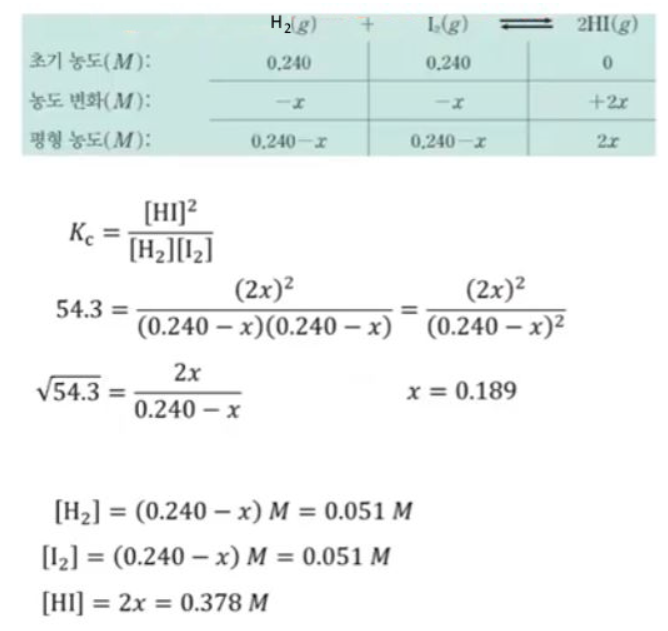
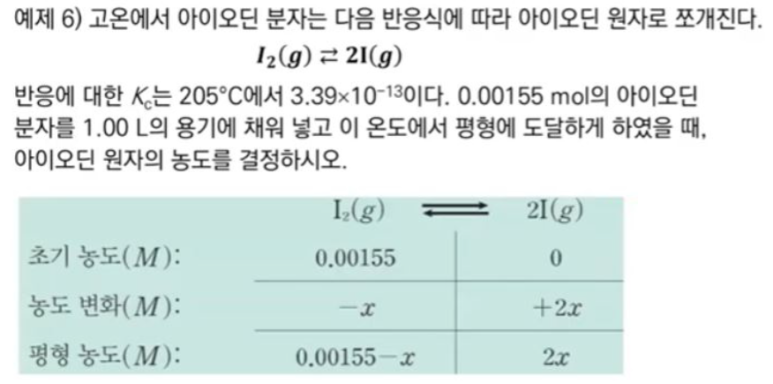
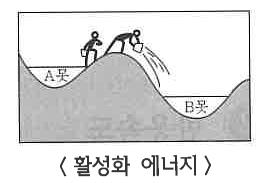
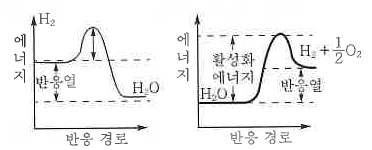
| 반응속도와 화학평형 (4) | 2024.11.21 |