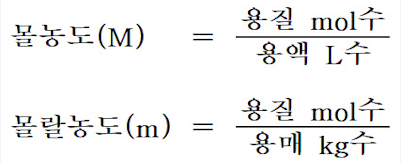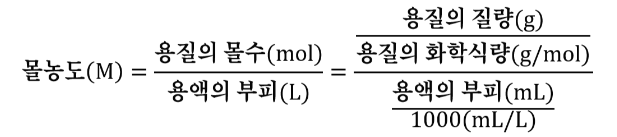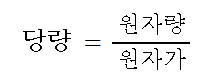▣ 탄화수소(Hydrocarbon)는 탄소(C)와 수소(H)만으로 이루어진 유기화합물을 말한다.
▣ 탄화수소의 종류
⊙ 지방족 - 사슬형 - 포화탄화수소
- 불포화탄화수소
- 고리형 - 포화탄화수소
- 불포화탄화수소
- 방향족
⊙ 방향족
※ 지방족에는 알칸류, 알켄류, 알킨류, 치환족이 있다.
▣ 탄화수소의 특징
⊙ 탄소(C) 하나에 최대 4개의 원자결합이 가능한데 다중결합으로 갈수록 결합력이 커지고, 분자반지름은 작아진다.
⊙ 탄화수소는 분자사이의 인력이 작으므로 녹는점, 끓는 점이 낮다.
⊙ 원자 사이의 인력은 공유결합으로 강하고 안정감이 높다.
⊙ 극성 용매에는 녹지 않으며 비극성 용매에 잘 녹는다.
⊙ 연소시 이산화탄소, 물이 생성되며, 연료로 많이 쓰인다.
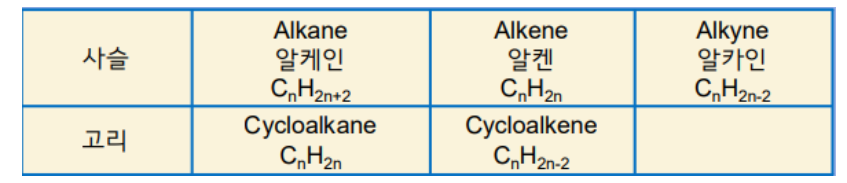
1. 알케인 (Alkane)
① 모두 단일결합으로 이루어져 있다.
② 사슬모양이며 분자식은 CnH2n+2 으로 나타낸다.
③ 분자량이 가장 작은 것은 CH4 (메테인, 메탄)이다.
④ 탄소와 수소만으로 이루어져 있다.
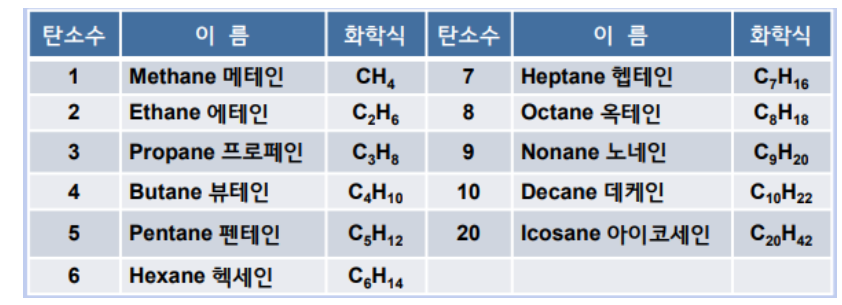
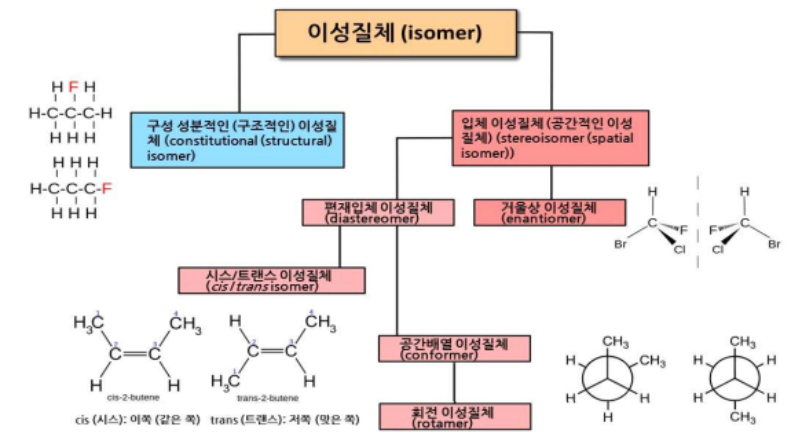
※ 이성질체 (Isomer) : 분자식은 같으나 분자내에 있는 구성원자의 연결방식이나 공간배열이 동일하지 않은 화합물
2. 알켄 (Alkene)
가. 포화탄화수소
① 포화탄화수소는 탄화수소 중 가장 단순하여 단일 결합으로 구성되어 있으며 수소로 포화되어 있다.
② 이중 결합이나 3중결합이 없는 지방족 포화탄화수소 및 지방족 고리 포화탄화수소로 되어 있다.
ex : 파라핀계 탄화수소 (골격을 이루는 탄소원자가 사슬모양으로 결합, 알켄으로 명명), 나프텐계 탄화수소 (골격을 이루
는 탄소 원자가 고리모양으로 결합, 사이클로알켄으로 명명)
나. 불포화 탄화수소
① 탄소원자 사이에 하나 이상의 이중 또는 3중결합을 갖는다.
② 불포화탄화수소 : 이중 결합이나 3중결합이 있는 탄화수소
ex : 올레핀계 탄화수소 (골격을 이루는 탄소가 사슬모양으로 결합, 알켄, 알카인으로 명명)
다. 방향족 탄화수소
① 아렌(arene)으로도 알려진 방향족 탄화수소는 적어도 하나의 방향족고리를 갖는 탄화수소이다.
② 벤젠과 같은 공명고리를 갖는 탄화수소
③ 방향족 탄화수소는 단일고리 방향족과 나프탈렌 같은 여러고리 (polycyclic) 방향족으로 분류된다.
④ 지방족 탄화수소와는 달리 고리를 구성하는 탄소원자들 사이에 시스마 결합과 비편재된 파이결합을 가지는 탄화수소
이다.
⑤ 방향족이라는 명칭은 방향족에 속하는 화합물이 달고 향긋한 냄새를 가져 명명되었다.
라. 지방족 탄화수소
① 지방족 포화탄화수소와 지방족 불포화탄화수소를 합쳐 지방족 탄화수소라고 한다.
마. 파라핀계 탄화수소 (지방족 포화탄화수소)
① 탄소가 사슬모양으로 연결된 것으로서 다른 결합수는 수소와 결합한 포화결합으로 되어 있는 탄화수소이다.
② 보통 CnH2n+2 로 표시되며 그중에서 가장 간단한 것은 메테인 (CH4)이다.
③ 메테인은 천연가스의 주성분이며, 유정에서 나오는 가스의 대부분을 차지한다.
바. 나프텐계 탄화수소 (지방족 고리 포화 탄화수소)
① 파라핀계와 마찬가지로 결합수가 모두 탄소화 수소로 채워져 있는 포화결합의 탄화수소이다.
② 골격을 이루는 탄소원자가 고리모양으로 결합된 것이 특징이다.
③ 석유 중에는 주로 탄소수가 5개인 사이클로펜테인 (Cyclopentane : C5H10), 탄소수가 6개인 사이클로헥세인
(Cyclohexane : C6H12)과 그 동족체가 있다.
④ 나프텐계 탄화수소는 일반적으로 파라핀계 탄화수소 보다도 융점이 낮고 액체를 이루는 것이 많다.
⑤ 윤활유나 기계유 등으로 흔히 쓰이고 있다.
사. 올레핀계 탄화수소 (지방족 불포화탄화수소)
① 파라핀계와 마찬가지로 탄소가 사슬모양으로 결합되어 있으나, 그 중에 탄소끼리의 이중결합이 하나 들어 있는 것이
특징이다.
② 보통 CnH2n 으로 표시되며 불포화결합이 있기 때문에 다른 물질과 결합하기 쉬운 성질이 있다.
③ 가장 간단한 에틸렌 (Ethylene : C2H4)의 명칭에서 유래하여 이 올레핀계를 에틸렌계 탄화수소라고도 부른다.
④ 올레핀계 탄화수소는 섬유성분으로는 거의 존재하지 않으며, 약간 들어 있는 경우에도 석유를 정제하는 단계에서 원유
로 부터 제거되고 만다.
#탄화수소 #hydrocarbon #지방족 #방향족 #사슬형 #고리형 #포화 #불포화 #알케인
#알켄 #나프텐계 #파라핀계 #올레핀계
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 알킬기(alkygroup) - 탄화수소 (hydrocarbon) (0) | 2024.12.08 |
|---|---|
| 지방족 탄화수소(Hydrocarbon) 유도체 (0) | 2024.12.08 |
| 물의 전기분해 원리를 알아 보자.. (0) | 2024.12.03 |
| 당량과 당량수 (2) | 2024.12.03 |
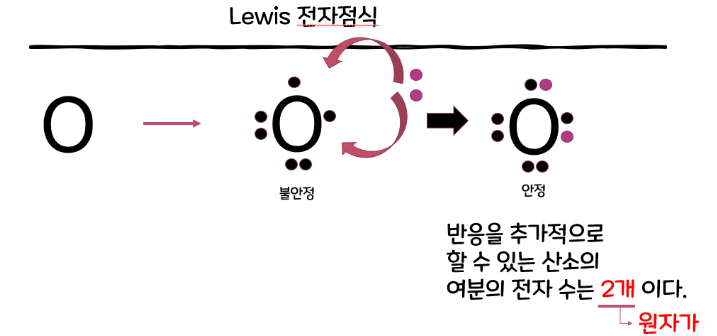
| 산화수 (Oxidation state) 계산방법 및 규칙 (0) | 2024.12.03 |