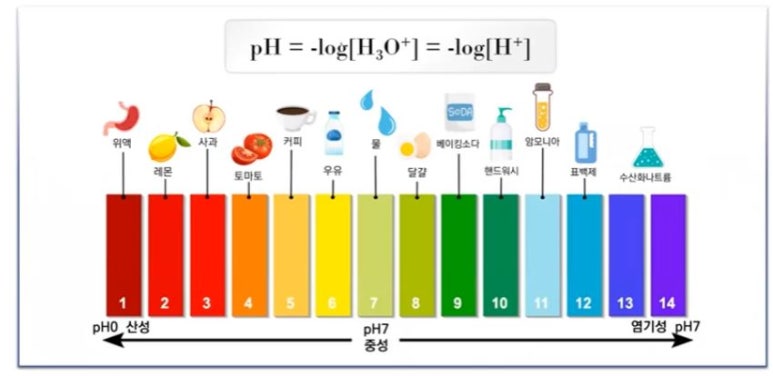
1. 산과 염기
▣ 산 (酸, acid) : 수용액 중에서 해리하여 수소이온을 생성하고 염기(鹽基)와 중화하여 염(鹽)을 만드는 물질.
예를 들면 염화수소(HCl)을 물에 녹이면 해리하여 오늄 이온인 하이드로늄(옥소늄)이온 H3O+ 을 생성
하고 산이 되는 것을 뜻한다. 신맛의 원인이 바로 수소 이온/하이드로늄 (옥소늄) 이온이다.
⊙ 산이란 물에 용해되어 H+를 내는 화학종이다.
⊙ 산이란 수소 이온을 잃는 화학종이다.
⊙ 산이란 용매의 양이온을 형성하는 물질이다
⊙ 좁은 의미로는 카복실기 있는 화합물만을 뜻하기도 한다(접미사가 -산(-acid)이다).
▣ 염기(鹽基, base)는 수용액에서 수산화 이온을 내거나 수소이온을 흡수하는 물질을 말한다.
흔히, 알칼리라고 부르며 산에 대응되는 물질로 서로 중화반응을 일으켜 염과 물을 만든다.
염기는 금속 산화물이다. 염기는 전해질이며 대체로 쓴맛이 나고, 손에 닿으면 단백질을 녹이는 성질 때문에
미끈거린다. 염기 물질은 보통 수소이온지수가 7 이상이다.
대표적인 염기는 강한 염기로 수산화나트륨(NaOH), 수산화칼륨(KOH), 수산화 칼슘 (Ca(OH)2) 등이 있고,
약한 염기로 암모니아수(NH4OH), 수산화 마그네슘 (Mg(OH)2)이 있다.
가. 산의 성질
① 수용액은 신맛을 낸다.
② 수용액은 푸른색 리트머스 종이를 붉은 색으로 변화시킨다.
③ 많은 금속과 작용하여 수소 (H2)가 발생한다.
④ 염기와 작용하여 염과 물을 만든다.
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 → FeSO4 + H2
나. 염기의 성질
① 쓴 맛이 있고, 수용액은 미끈 미끈하다.
② 수용액은 붉은 리트머스 종이를 푸르게 변화시킨다.
③ 산과 만나면 산의 수소 이온 (H+)의 성질을 해소시킨다.
④ 염기중 물에 녹아서 OH- 을 내는 것을 알칼리라 한다.
라. 산과 염기의 개념
▣ 아레니우스 (Arrhenius)의 산과 염기
① 산 : 수용액 중에서 수소 이온 (H+)을 내놓는 물질
② 염기 : 수용액 중에서 수산화 이온 (OH-)을 내놓는 물질
▣ 브뢴스테드 - 로우리 (BrØnsted-Lowry)의 산과 염기
① 산 : H+ (양성자)을 내놓는 물질 (양성자 주게)
② 염기 : H+ (양성자)을 받아 들이는 물질 (양성자 받게)
③ 양쪽성 물질 : 양성자를 받을 수도 있고, 양성자를 낼 수도 있는 물질
ex : H2O, HCO3-, HS-, H2PO4-, HPO4-, HPO42-
▣ 루이스 (Lewis)의 산과 염기
① 산 : 비공유 전자쌍을 제공받는 물질 (전자쌍 받게)
② 염기 : 비공유 전자쌍을 제공하는 물질 (전자쌍 주게)
<산·염기에 대한 여러가지 개념>
|
분류
학설
|
산
|
염기
|
|
아레니우스설
|
수용액에서 H+ (또는 H3O+)을 내놓는 것
|
수용액에서 OH-를 내놓는 것
|
|
브륀스테드설
|
H+ 을 줄 수 있는 것
|
H+을 받을 수 있는 것
|
|
루이스설
|
비공유 전자쌍을 받는 것
|
비공유 전자쌍을 가진 것 (제공하는 것)
|
마. 산화물 (출제빈도 높음) ★★★
▣ 물에 녹으면 산·염기가 될 수 있는 산소와의 결합물을 산화물이라 한다.
① 산성 산화물 (무수산) : 물과 반응하여 산이 되거나 또는 염기와 반응하여 염과 물을 만드는 비금속 산화물을
산성 산화물이라 한다.
ex : CO2 + H2O → H2CO3 (탄산) ⇔ 2H+ + CO32-
② 염기성 산화물 (무수염기) : 물과 반응하여 염기가 되거나 또는 산과 반응하여 염과 물을 만드는 산화물을
염기성 산화물이라 한다.
ex : CaO + H2O → Ca(OH)2 ⇔ Ca2+ + 2OH-
<참고> 산성산화물은 비금속의 산화물, 염기성 산화물은 금속의 산화물이다.
CO2, SO3, N2O5는 물에 녹아 H2CO3, H2SO3, HNO3가 되어 산이 된다.
또한, Na2O, CaO는 물에 녹아 NaOH, Ca(OH)2가 된다,
③ 양쪽성 산화물 : 산에도 녹고 염기에도 녹아서 수소가 발생하는 원소(Al, Zn, Sn, Pb 등)를 양쪽성 원소라 하며,
이들의 산화물 (Al2O3, ZnO, SnO 등)을 양쪽성 산화물이라 한다.
이들은 산 · 염기와 작용하여 물과 염을 만든다.
<참고> 양쪽성 산화물 ⇒ 산 · 염기와 반응
양쪽성 원소 Al, Zn, Sn, Pb의 산화물은 산과 염기와 반응하여 염이 된다.
※ 알(Al), 아(Zn), 주(Sn), 납(Pb) ? 양쪽성 물질
2. 산과 염기의 당량
가. 산의 당량
▣ 염산(HCl) 1몰이 만드는 수소 이온 (H+)은 1g 이온 (아보가드로수 6.02 × 1023개의 이온)이며
황산(H2SO4) 1몰이 만드는 수소 이온 (H+)은 2g 이온이 된다.

나. 염기의 당량
▣ 수산화나트륨(NaOH) 1몰이 만드는 수산 이온 (OH-)은 1g 이온이다.
수산화 칼슘(Ca(OH)2) 1몰이 만드는 수산이온 (OH-)은 2g 이온이다.

<참고> 원자가와 당량
▣ 대부분의 물질을 구성하고 있는 기본이 되는 화학적 본질을 원소라 한다. 각 원소의 원자량은 원자량이 12인 탄소-12
를 기준으로 하여 비례적으로 결정한다. 한 원소의 원자가는 원자가를 1로 하는 수소원자의 결합력을 기준으로 비례
적으로 결정한다. 즉, 원자가가 +3인 어느 원소는 화합물에서 3개의 수소원자를 대신할 수 있으며, -3가인 원소는 3개
의 수소원자와 반응할 수 있다.
▣ 원소의 당량은 그 원소의 원자량을 원자가로 나눈 값으로 정의된다.
1. 원자 및 이온의 당량 = 원자량 / 원자가
ex) Ca2+ 당량 = 40 / 2 = 20
Mg2+ 당량 = 24 / 2 = 12
2. 분자(화합물)의 당량 = 분자량/양 이온의 가수
ex) CaCO3 당량 = 100 / 2 = 50
CaSO4 당량 = 136 / 2 = 68
3. 산의당량 = 분자량 / H+의 수, 염기의 당량 = 분자량 / OH-의 수
ex) HCl 당량 = 36.5 / 1 = 36.5
H2SO4 당량 = 98 / 2 = 49
NaOH 당량 = 40 / 1 = 40
Ca(OH)2 당량 = 74 / 2 = 37
4. 산화제 및 환원제의 당량 = 분자량 / 주고 받은 전자수
ex) KMnO4 당량 = 158 / 5 = 31.6
K2Cr2O7당량 = 294 / 6 = 49
◈ 과망간산의 경우 : MnO4- + 8 H+ + 5e- ⇒ Mn2+ + 4 H2O
◈ 중크롬산칼륨의 경우 : Cr2O72- + 14 H+ + 6e- ⇒ 2Cr3+ + 7 H2O
산 : 물에 용해되어 H+이온을 제공해주는 물질 (HCl, HNO3, H2SO4, H3PO4)
◈ 강산 : 수용액에서 완전히 해리되는 강전해질인 산 (HClO4, H2SO4, HBr, HCl, HNO3)
◈ 약산 : 부분적으로만 해리되는 약전해질인 산 (CH3COOH), HF, H3PO4 HNO2)
염기 : 물에 용해되어 OH-이온을 제공해주는 물질 (NaOH, Ba(OH)2, KOH)
◈ 강염기 : 수용액에서 해리되어 OH이온을 내어놓는 정도가 강한 염기 (NaOH, KOH, Ba(OH)2, Ca(OH)2)
◈ 약염기 : 암모니아는 그 일부가 물과 반응하여 NH4+와 이온을 내놓기 때문에 약염기이다.
◈ 전해질 : 물에 녹아 이온성 용액을 만드는 물질
<산화와 환원>
산화 : 산소-산소와 화합하는 현상
수소 - 수소화합물에서 수소를 잃는 현상
전자 - 전자를 잃는 현상
원자가 - 원자가(산화수)가 증가되는 현상
산화제 : 하나 또는 그 이상의 전자를 얻으며 자신은 환원되고 원자의 산화수가 감소한다.
환원 : 산소- 산화물에서 산소를 잃는 현상
수소-수소와 화합하는 현상
전자-전자를 받아들이는 현상
원자가-원자가(산화수)가 감소되는 현상
환원제 : 하나 또는 그 이상의 전자를 잃으며 자신은 산화되고 원자의 산화수는 증가한다.
3. 산과 염기의 세기
가. 전해질과 비전해질
① 전해질 : 수용액 상태에서 전기가 통하는 물질이고 수용액에서 이온화하는 물질이다.
ex : NaCl → Na+ + Cl-
② 비전해질 : 물에 녹았을 때 이온으로 나누어지지 않는 물질로서, 주로 공유결합 화합물이다.
나. 이온화도
▣ 전해질 수용액에서 용해된 전해질의 몰수에 대한 이온화된 전해질의 몰수의 비 (이온화 : 양이온과 음이온으로 분리)

※ 같은 물질인 경우 이온화도는 온도가 높을 수록, 전해질의 농도가 묽을 수록 커진다.
4. 물의 이온적과 수소 이온 농도
가. 물의 이온적
▣ 물은 상온에서 이온화되어 다음과 같이 평형 상태를 유지한다.
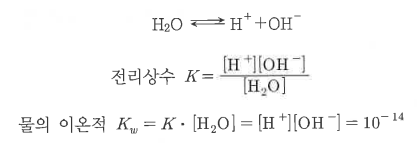
나. 수소 이온 농도
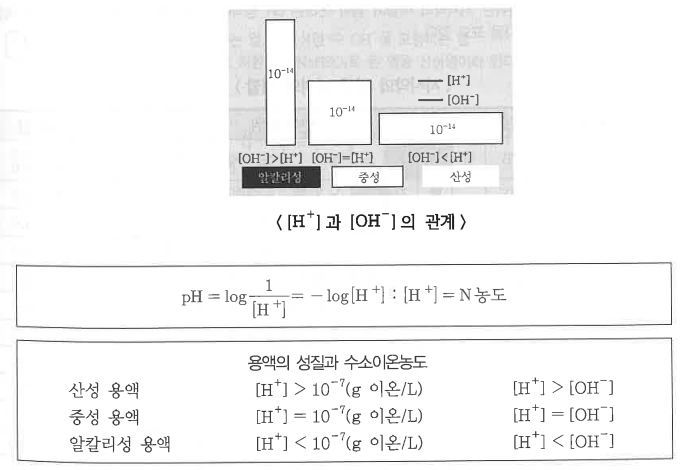
▣ 수용액에서의 수소이온농도는 매우 작기 때문에 pH로 산성도를 나타내는 것이 편리하다.
pH는 수소이온에 물 농도의 음의 대수값으로 정의된다.
※ 수소 이온 지수
◈ 수소이온농도의 역수를 상용대수로 나타낸 값을 pH라 하며 이것을 수소이온지수라고 한다.
수소이온지수를 사용하면 용액의 산성, 염기성을 더욱 간단한 값으로 나타낼 수 있다.
5. 산 · 염기의 중화 반응
가. 중화반응과 염
▣ 염산 수용액에 수산화나트륨 수용액을 더해 가면 염산의 산성은 차츰 약해져서 나중에는 산성도 알칼리성도 아닌 중성
이 되어 버린다. 이와 같은 반응을 중화반응이라 하며 중화로 생성된 물질 (이 반응에서는 NaCl)을 염이라 한다.
나. 중화적정과 염
① 중화반응 : 산과 염기가 반응하여 물과 염이 생성되는 반응
㉠ 중화반응의 알짜 이온 방정식 : H+ (aq) + OH- (aq) ⇒ H2O (l)
㉡ 중화반응에서의 양적 관계 : 산과 염기가 완전히 중화되면 산이 내놓는 H+ 의 몰수와 염기가 내놓는 OH- 의 몰수가
같다.
* nMV = n' M'V'
여기서, n, n' : 가수, M, M' : 몰 농도, V, V' : 부피
※ 여러 가지 지시약의 변색 범위 : 지시약의 변색 범위란 지시약의 색깔이 점차 변하는 pH 영역이다.
몇 가지 중요한 지시약들의 색깔과 변색 범위는 다음 표와 같다.
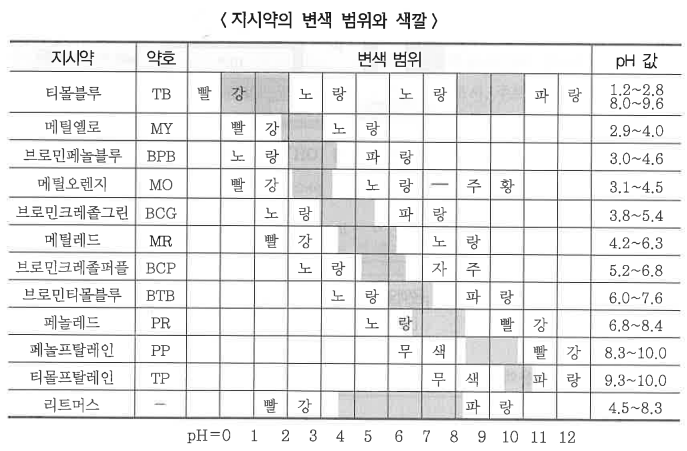
◈ pH 측정 : 정확한 pH를 측정할 때는 pH미터를 사용한다.
◈ 페놀프탈레인
⊙ 산성, 중성 ⇒ 무색
⊙ 염기성 ⇒ 붉은 색
⊙ 변색 범위 : 8.3 ~ 10.0
⊙ 강한 염기로 중화 적정할 때 쓰인다.
② 염의 의의 및 종류 : 염이란 산의 음이온과 염기의 양이온이 만나서 이루어진 이온성 물질이다.
㉠ 산성염
⊙ 산의 H+ (수소 원자) 일부가 금속으로 치환된 염을 산성염이라 한다.
ex : H2SO4 + NaOH ⇒ NaHSO4 + H2O (황산수소나트륨 + 물)
H2CO3 + KOH ⇒ KHCO3 + H2O (탄산수소칼륨 + 물)
㉡ 염기성염
⊙ 염기 중의 OH- 일부가 산기(할로겐)로 치환된 염을 염기성염이라 한다.
ex : Mg(OH)2 + HCl ⇒ Mg(OH)Cl + H2O (하이드록실 염화 마그네슘)
<참고> 산성염 ⇒ H+을 포함하는 염,
염기성염 ⇒ OH- 을 포함하는 염
H2SO4 의 H 1개가 Na로 치환되어 NaHSO4 로 된 염을 산성염이라 한다.
㉢ 정염
⊙ 산 중의 수소 원자 (H) 전부가 금속으로 치환된 염을 정염이라 한다.
ex : NaOH + HCl ⇒ NaCl + H2O
2NaOH + H2SO4 ⇒ Na2SO4 + 2H2O (황산나트륨 + 물)
㉣ 복염
⊙ 두가지 염이 결합하여 만들어진 새로운 염으로서 이들 염이 물에 녹아서 성분염이 내는 이온과 동일한 이온을 낼 때
이 염을 복염이라 한다.
ex : K2SO4 + Al2(SO4)3 + 24 H2O ⇒ 2 KAl(SO4)2 · 12 H2O (칼륨알루미늄배반 + 물)
이 때 성분염이 물에 녹아서 내는 이온 K2SO4 ⇒ 2K+ + SO42-
Al2(SO4)3 ⇒ 2Al3+ + 3SO42-
생성염이 물에 녹아서 내는 이온 2KAl(SO4)2 ⇒ 2K+ + 2Al3+ + 4SO42+
성분염과 생성염은 물에 녹아서 동일한 이온을 내므로 KAl(SO4)2는 복염이다.
㉤ 착염
⊙ 성분염과 다른 이온을 낼 때 이 염을 착염이라 한다.
ex : FeSO4 + 2KCN ⇒ Fe(CN)2 + K2SO4
Fe(CN)2 + 4KCN ⇒ K4Fe(CN)6 (시안화철(Ⅱ)산 칼륨)
이 때 성분염이 물에 녹아서 내는 이온 Fe(CN)2 ⇒ Fe2+ + 2CN-
4KCN ⇒ 4K+ + 4CN-
생성염이 물에 녹아서 내는 이온 K4Fe(CN)6 ⇒ 4K+ + Fe(CN)64-
시안화철(Ⅱ)산 칼륨 시안화철(Ⅱ)산 이온
즉, 성분염과 생성염은 물에 녹아서 동일한 이온을 내지 않으므로 K4Fe(CN)6 은 착염이다.
다. 염의 가수분해
▣ 염으로 부터 해리되어 나온 이온이 물과 반응하여 H3O+ 이나 OH-을 내는 반응이다.
라. 완충 용액
▣ 적정곡선에서 알 수 있는 것 처럼 중성에 가까운 수용액에서는 염산이나 수산화나트륨을 소량 가하면 pH가 크게
변한다. 그러나 약산에 그 약산의 염을 혼합한 수용액에 소량의 산이나 염기를 가해도 pH는 그다지 변화하기 않는다. 이런 용액을 완충용액이라 한다.
<참고> 완충용액 ⇒ 산이나 염기를 가해도 pH가 거의 일정
◈ 약산에 염을 혼합한 용액은 산이나 염기를 가해도 별로 pH가 변화하지 않는다. 이것은 전리 평형과 공통 이온에 의해
평형 이동을 응용한 것이다.
#산 #염기 #중성 #산화제 #환원제 #중화반응 #원자가 #산성염 #복염 #정염 #착염 #전해질 #이온화도
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 산화 · 환원 반응 (화학반응) (6) | 2024.11.17 |
|---|---|
| 용액과 용해도 (0) | 2024.11.13 |
| 물질의 화학결합 (0) | 2024.11.09 |
| 원자의 구조와 원소의 주기율 (8) | 2024.11.07 |
| 물질의 상태와 변화 (6) | 2024.11.06 |
