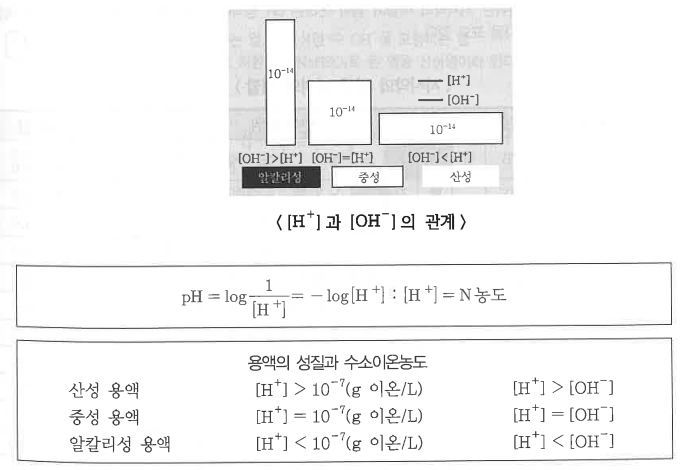
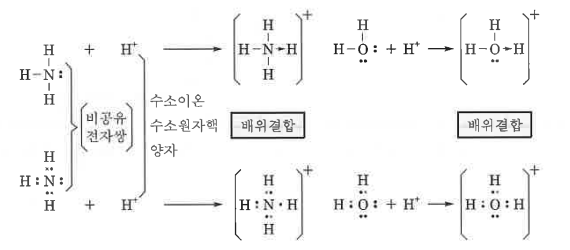
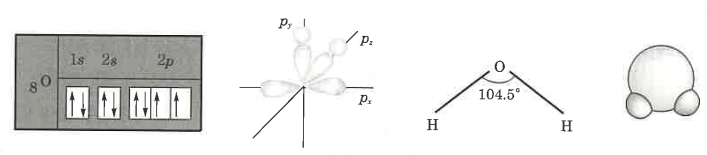
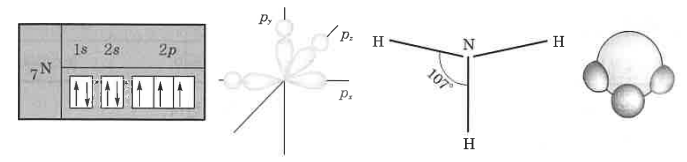
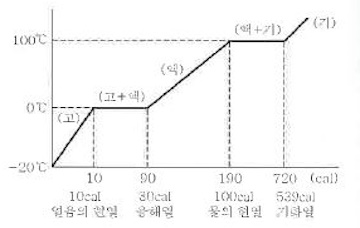
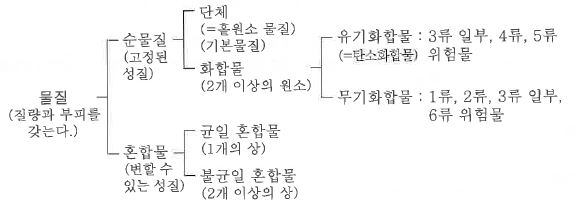
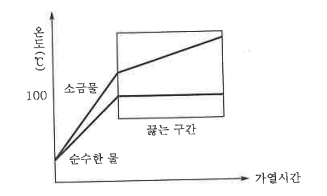
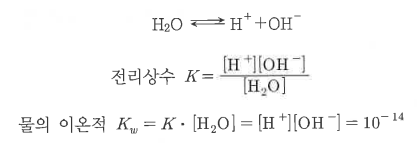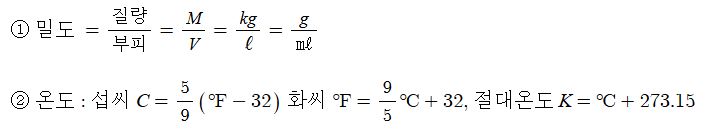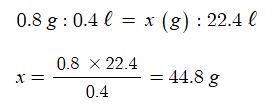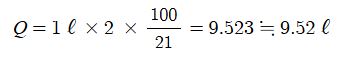1. 산화 · 환원의 개념
▣ 산화 · 환원 반응(酸化 · 還元反應, Redox, reduction-oxidation)은 원자의 산화수가 달라지는화학반응이다. 산화·환원
반응은 화학종 사이의 실제 또는 형식적인 전자 이동을 특징으로 하며, 가장 흔히 한 종(환원제)은 산화(전자 손실)를
겪고 다른 종(산화제)은 환원(전자획득)을 겪는다.
전자가 제거된 화학종은 산화되었다고 하고 전자를 얻은 화학종은 환원되었다고 한다.
◈ 산화(Oxidation)는 분자, 원자 또는 이논이 산소를 얻거나 수소 또는 전자를 '잃는' 것을 말한다.
◈ 환원(Reduction)은 분자, 원자 또는 이온이 산소를 잃거나 수소 또는 전자를 '얻는' 것을 말한다.

▣ 산화, Oxidation, Oxygen을 즉, 산소를 추가했다고 생각할 수 있다. 산화는 산소와 결합하는 반응이다.
산소는 전기음성도가 2번째로 세다. 불소(F)가 제일 세고, 산소와 결합하면 산소는 전자쌍을 자기 쪽으로 끌어 당기는
힘이 무척 센 원자이기 때문에 산소에게 전자를 빼앗겼다는 것이다.
산화를 예전에는 산소와 결합에 초점을 두었다면 요즘은 전자를 빼앗기는데 초점을 둔다. 환원은 산화와
완전히 반대되는 개념이다. 결합되었던 전자를 다시 회복하는 반응이다.
▣ 산화, 환원 반응의 동시성은 어떤 물질이 산화되었다는 것은 전자를 빼앗겼다는 이야기이다. 그럼 전자를 빼앗아간
물질이 있을 것이다. 전자를 내놓는 물질이 있으면 반드시 전자를 얻는 물질이 동시에 그 주변에서 일어 날 수 밖에
없다는 것이다. Na 고체와 Cl2 기체가 만나면 NaCl 고체가 즉 소금이 생기는데 엄청난 양의 빛을 내면서 소금이 생긴
다. 이 때 Na는 전자를 잃고 Cl은 전자를 얻는 즉, Na는 산화되고 Cl은 환원되고 산화되는 반응을 산화 반쪽 반응, 환원
되는 반응만 쓰는 것을 환원 반쪽 반응이라고 한다.
2. 산화수 (출제빈도 높음) ★★★
가. 산화수
▣ 물질을 구성하는 원소의 산화상태를 나타낸 수 (= 물질의 산화된 정도를 나타내는 수)

▣ 산화, 환원 반응을 숫자로 계산하려고 만들어 낸 개념이 산화수이다.
▣ 철은 철 원소만 있을 때는 전하량이 없으니까 "0"이다. 그런데 산소와 결합했다면 산소는 전자 2개를 빼앗는 것이 기본
인데 산소가 3개 이니까 전자 6개가 부족하다.
따라서, 철 하나당 전자 3개를 담당하여 전체적으로 "0"이 되어 화합물이 되는 것이다.
철은 0에서 +3이 되었으니 전자를 잃어 산화된 것이고
산소는 0에서 2-가 되었으니전자를 얻어 환원된 것이다.
나. 산화수의 정의
▣ 산화수 (Oxidation Number, 또는 산화 상태)
⊙ 공유결합에서 모든 전자가 전기음성도가 큰 원자에 속한다는 가정하에 원자에 임의로 할당된 전하
▣ 반응 전후에 한 원자의 산화수를 비교하면 원자들이 전자를 얻었는지 또는 잃었는지를 알 수 있음
▣ 반드시 이온 전하를 의미하지는 않는다는 것에 유의해야 함
▣ 산화 - 환원 반응에서 전자의 추적에 도움을 주는 단순하고 편리한 방법임
▣ 물의 경우에는 H2O는 H2와 O가 공유결합을 한다. 이 때 전자를 산소쪽으로 살짝 당겨지긴 하지만 그렇다고 수소가
완전히 전자를 잃어 버린 것은 아니다. 공유결합은 이온결합 처럼 전하수가 주고 받는 것이 명확하지 않으므로 이럴 때
는 전자를 얻는 것인지 잃는 것인지 모호할 수 있다.
따라서 공유결합한 두원자 중에서 전기음성도가 큰 원자가 전자를 가져갔다고 본다.
그래서 산소가 최외각 껍질 전자가 6개가 있었는데 수소의 전자 2개를 가져가 산소는 전자가 8개가 된다.
산화수는 원래의 원자 최외각 전자수 빼기, 공유 전자를 전기음성도가 센 원자가 전자를 가져간다고 가정했을 때,
이 전자수를 빼서 계산하면 6 - 8 = -2 가 된다.
수소는 최외각 전자가 1개 있는데 이것을 빼앗겼으니까 전자가 없는 것과 마찬가지가 되었다.
그래서 수소는 1 - 0 = +1 이 된다.
이것이 산화수 개념이다.
다. 산화수 규칙
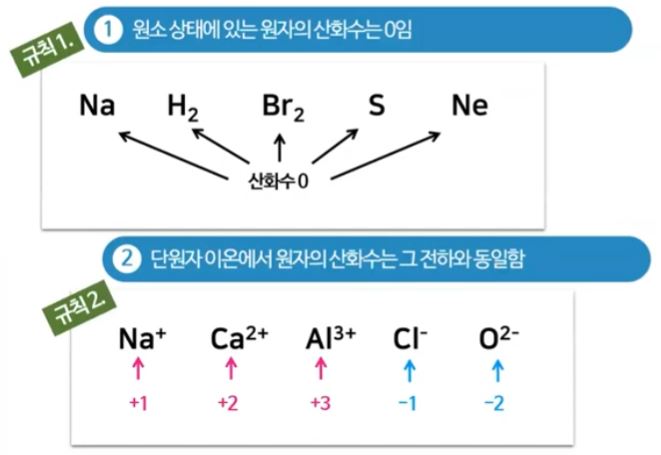
▣ 홑 원소 물질로 된 원소상태에 있는 물질들은 산화수가 모두 "0"이다.
이 물질은 다른 물질과 결합한 것이 아니므로 전자를 빼앗기거나 가져오지 않은 상태이다.
그런데 이 물질, 원자 하나가 이온화를 하면 단원자 이온에서 원자의 산화수는 그 이온이 가지는 전하수와 같다.
원자 하나가 이온이 되었을 때 산화수는 그 물질의 전하수이다.
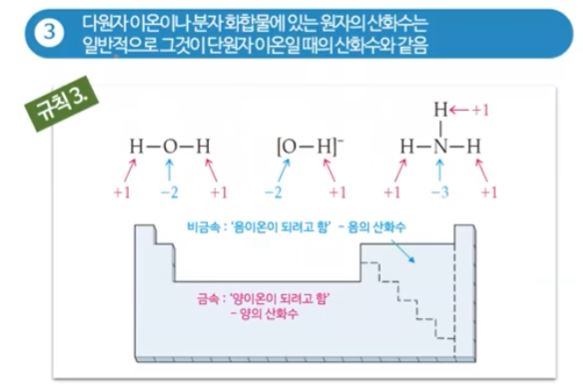
▣ 다원자 이온일 때는 물(H2O)을 예로 들면, 다원자 이온이나 분자화합물이 있을 때는 물은 산소가 전자를 세게 당기므
로 산소는 특별하지 않은 경우 산화수는 -2이다.
대부분의 산소는 최외각 껍질 전자가 6개로 전자 2개를 가져 오므로 산소는 -2, 수소는 +1이 된다.
▣ 그런데 O-H 라는 수산화이온은 왜 생겼을까 ?
산소가 -2 이고, 수소가 +1이고 나트륨은 +1이기 때문에 특별하지 않을 때는 산소원자 하나와 수소원자 1개와 나트륨
1개가 결합하여 수산화나트륨 (NaHO)이 되지만, 무슨 일에 의해서 인지는 모르지만 Na - O - H의 분자구조에서 Na가
떨어져 나가 Na+가 되고 O-H- 의 불완전한 이온이 되는 경우가 있다.
이렇게 하여 생긴 이온이 수산화이온 (OH-)이 된다.
암모니아는 수소보다 질소가 전자를 당기는 힘이 세서 수소가 +1, 질소가 -3이 된다.
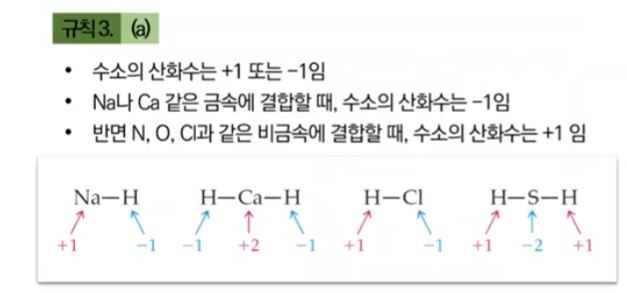
▣ 수소는 최외각 껍질 전자수가 1개인데
첫번째 껍질은 전자가 최대 들어가 봐야 2개가 들어 가므로 여기에 전자가 하나 있다는 것은 반만 채워진 개념이다.
수소는 주기율표에서 자신보다 왼쪽에 있는 금속과 만나면 이들 금속보다 전자를 세게 당기니까 수소가 마이너스(-)로
작용하고 오른쪽에 있는 비금속을 만나면 전자를 세게 당기지 못하므로 전자를 잃어 플러스 (+)로 작용한다.
따라서 수소의 산화수는 +1 이거나 -1이다.
그런데 수소가 탄소와 결합할 때에는 비극성, 무극성 공유 결합이 된다.
이들간에는 전자의 쏠림현상이 없다.
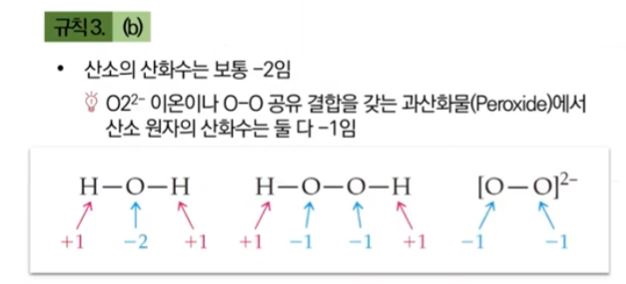
▣ 산소는 일반적으로 산화수가 -2이다. 그런데 그렇지 않은 경우가 있다.
OF2 라는 분자이다. 불소 (F)는 전기음성도에서 범접 불가이다. 전기형성도가 무조건 제일 세다.
불소(F)는 어느 물질에서든 전자를 항상 빼앗아 오는 물질이다.
그리고 최외각 전자가 7개라서 항상 산화수는 -1이다.
그런데 불소(F) 2개가 있으니 산화수는 +2가 된다.
산소는 일반적으로 전자를 빼앗는 -2의 역할을 하지만 불소를 만나면 전자를 빼앗기는 +2 의 역할로 변한다.
▣ H2O2는 산소보다 전자를 못 빼앗으므로 오히려 산소보다 전기 음성도가 작으니까 수소 +1 이 2개 있고
원래 산소는 -2가 되어야 하는데 수소가 줄 수 있는 전자가 없어서 -1개 짜리 2개인 과산화, 불안정한 물질이 된다.
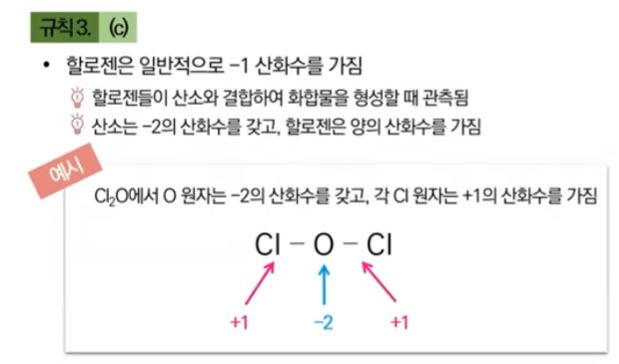
▣ 할로젠, F, Cl, Br, I 는 일반적으로 산화수 -1을 갖는다.
17족 원소이니까 최외각 전자수가 7개 있다.
그런데 Cl2O라는 분자로 있을 때는 F, Cl, Br, I 계열 원소중 F는 산소보다 전기 음성도가 크지만
Cl, Br, I 는 산소(O)보다 전기음성도가 크지 않다.
따라서 Cl2O 에서 O는 -2이고 Cl 원자 하나가 +1을 가질 수 밖에 없다.
F를 제외한 Cl, Br, I 는 산소(O)와 만나면 상황이 달라진다.

▣ 중성인 분자에서는 산화수 합이 분자가 되고 H2SO4에서 분자면 "0"이 되고
산화수의 합이 "0"이 되어야 한다. 따라서 합이 "0"이 되려면 S는 +6이 된다.
▣ 다원자 이온에서는 산화수 합이 알짜 전하수와 같다.
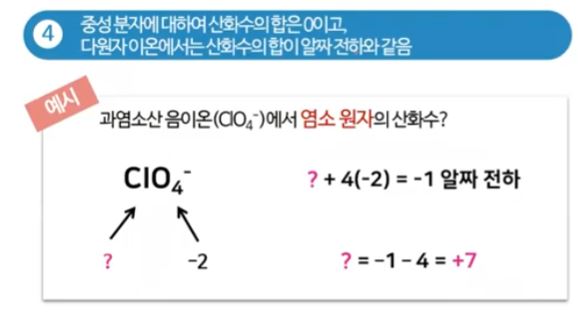
▣ ClO4-, 과염소산 이온인데 여기에서 산소는 일반적인 경우로 산화수가 -2이고
산화수의 합이 -1이 된다는 것이다. 그러면 Cl은 +7이 되어야 한다.
① 자유상태에 있는 원자, 분자의 산화수는 "0"이다.
ex : He, Cl2, O2, N2 등
② 단원자 이온의 산화수는 이온의 전하와 같다.
ex : Cu2+ : 산화수 +2, Cl- : 산화수 -1
③ 화합물 안의 모든 원자의 산화수 합은 "0"이다.
ex : H2SO4 : (+1×2) + (+6) + (-2×4) = 0
④ 다원자 이온에서 산화수 합은 그 이온의 전하와 같다.
ex : MnO4- : (+7) + (-2×4) = -1
⑤ 알칼리 금속, 알칼리토금속, ⅢA족 금속의 산화수는 +1, +2, +3 이다.
⑥ 불소화합물에서 불소의 산화수는 -1, 다른 할로겐은 -1이 아닌 경우도 있다.
⑦ 수소의 산화수는 금속과 결합하지 않으면 +1, 금속의 수소화물에서는 -1 이다.
ex : HCl, NH3, H2O, NaH, MgH2, CaH2, BeH2
⑧ 산소의 산화수 = -2, 과산화물 = -1, 초과산홤루 = -1/2, 불산화물 = +2
ex : Na2O, Na2O2, NaO2, OF2
⑨ 주족 원소 대부분은 [ⅠA족 +1] [ⅡA족 +2], [ⅢA족 +3], [ⅣA족 ±4], [ⅤA족 -3, +5]
[ⅥA족 -2, +6], [ⅦA족 -1. +7]
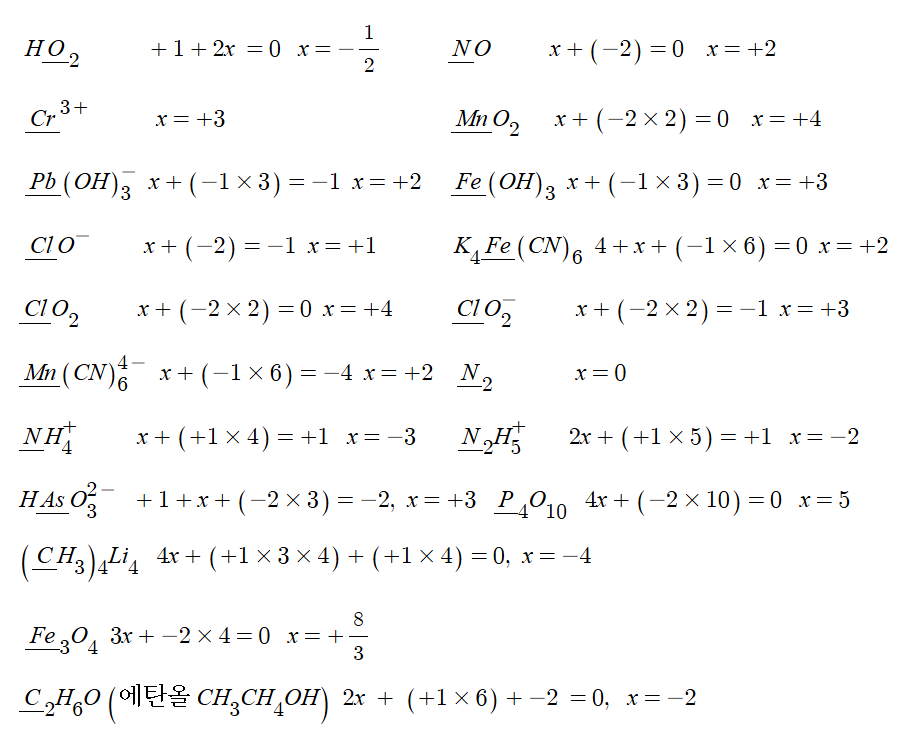
3. 산화제와 환원제
가. 산화제와 환원제
① 산화제 : 자신은 환원되면서 다른 물질을 산화시키는 물질, 즉, 자신은 환원되고 남을 산화시킴
② 환원제 : 자신은 산화되면서 다른 물질을 환원시키는 물질, 즉, 자신은 산화되고 남을 환원시킴
③ 산화제의 조건
㉠ 전자를 얻기 쉬울 것 : 17족 (F2, Cl2, Br2, I2)
㉡ 산화수가 큰 원자를 가질 것 (MnO2, KMnO4, K2Cr2O7)
④ 환원제의 조건
㉠ 전자를 내기 쉬울 것 : 금속 (K, Na, Ca)
㉡ 산화수가 작은 원자를 가질 것 (C, SCl2, H2S)

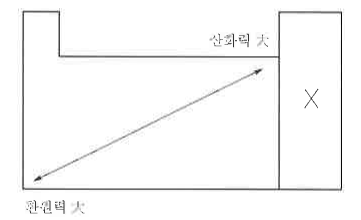
나. 산화력, 환원력의 크기
▣ 산화(산화수 증가)되는 물질 ⇒ 환원제이고 환원력이 세다.
▣ 환원 (산화수 감소)되는 물질 ⇒ 산화제이고 산화력이 세다.
※ 주기율표와 관계
다. 산화수와 산화 · 환원의 관계
① 산화 : 산화수가 증가하는 반응 (전자를 잃음)
② 환원 : 산화수가 감소하는 반응 (전자를 얻음)
4. 산화 · 환원 방정식 (산화수법)
① 산화수를 조사하여 산화수의 증가, 감소량을 구한다.
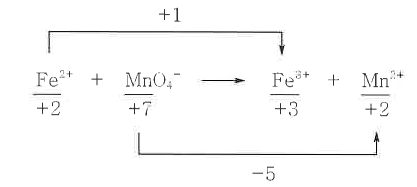
② 산화 반쪽 반응식 : Fe2+ → Fe3+ + e- ……………… ㉠
환원 반쪽 반응식 : 5e- + MnO4- → Mn2+ ……………… ㉡
㉠ × 5 : 5 Fe2+ → 5Fe3+ + 5e- ………………… ㉢
㉡ + ㉢ : 5Fe2+ + MnO4- → 5Fe3+ + Mn2+ ………… ㉣
③ 산소 원자의 개수는 H2O로 맞춰준다. 따라서 ㉣에서 우측에 4몰의 H2O를 더해 준다.
5Fe2+ + MnO4- → 5Fe3+ + Mn2+ + 4H2O
④ H2O로 인해 수소 원자 개수를 왼쪽의 H+로 맟춰준다.
5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O
5. 전기화학
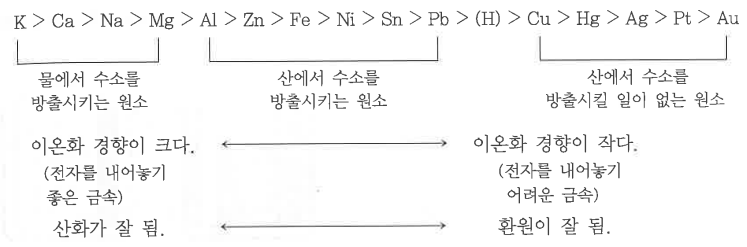
가. 금속의 이온화 경향
▣ 금속원소는 여러가지 비금속 원소나 원자단과 화합물을 만든다.
화합물 중의 금속원자는 전자를 잃어 버리고 양이온으로 된다. 이 처럼 금속원자는 한개 또는 수개의
최외각 전자를 잃어 양이온이 되려는 성질이 있다. 이를 이온화 경향이라 한다.
나. 금속의 이온화와 화학적 성질
① 금속의 반응성 : 금속이 비금속과 화합할 때 금속은 양이온이 되고, 비금속은 음이온이 된다.
따라서 금속 단체가 반응하는 경우, 전자를 상대에게 주고 양이온이 되는 반응을 한다.
그러므로 일반적으로 이온화 경향이 큰 금속일수록 반응하기 쉬운 금속에 속한다.
<참고> 이온화 경향이 큰 금속은 화학반응이 활발하고, 역으로 이온화 경향이 작은 금속은 화학반응을 잘 안한다.
② 공기 중의 산소와의 반응 : 이온화 경향에 따라 다음과 같이 반응한다.
㉠ K, Ca, Na, Mg : 상온의 건조된 공기 중에서 산화한다.
㉡ Al, Zn, Fe, Ni, Sn, Pb, Cu : 습한 공기 중에서 산화되고 건조한 공기 중에서는 표면만 산화된다.
㉢ Hg, Ag, Pt, Au : 공기중에서는 변화가 없다.
③ 물과의 반응 : 이온화 경향에 따라 다음과 같이 반응한다.
㉠ K, Ca, Na : 상온에서 물과 격렬하게 반응하여 수산화물이 생성되고, 수소가 발생한다.
㉡ Mg, Al, Zn : 찬물과는 반응하지 않으나 더운 물 또는 수증기와 반응하여 수소가 발생한다.
㉢ Fe는 고온에서 고온의 수증기와 반응하며 가역반응을 한다.
다. 화학전지
▣ 자발적 산화 · 환원 반응을 이용하여 화학에너지를 전기에너지로 바꾸는 장치로서, 다시 말해서 화학변화를 이용하여
전자를 흐르게 하는 장치를 말한다.
라. 화학전지의 종류
① 볼타 전지 : 구리는 수소 보다 이온화 경향이 작아 반응하지 않는다. 아연은 수소보다 반응성이 크기 때문에 묽은 황산
과 반응하여 아연이 산화되고 (전자 잃음) 수소이온이 수소기체로 환원된다.
(-) Zn Ⅰ H2SO4 Ⅰ Cu (+), E° = 1.1 V
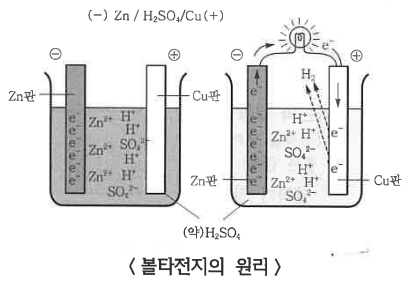
㉠ (-)극 아연판 : 질량 감소 : Zn → Zn2+ + 2e- (산화)
㉡ (+)극 구리판 : 질량 불변 : 2H+(aq) + 2e- → H2 (g) (환원)
㉢ 전체 반응 : Zn + 2H+ → Zn2+ + H2
<참고> 분극작용
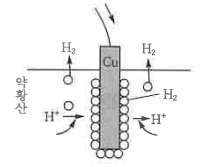
⊙ 위 그림은 Cu판 표면에 H2 기체가 발생하므로 전지의 기전력이 떨어진다. 따라서 이러한 분극작용을
없애기 위해서 MnO2와 같은 감극제를 상용한다.
<참고> 염다리 (Salt bridge)란 ?
◈ 다른 이온 또는 물질과 반응하지 않는 NaNO3 (aq) 같은 전해질 용액을 채운 U자 모양 유리관으로 만들며, 전극에서
산화와 환원반응이 일어나면 염다리에서 이온이 이동하여 전기적으로 중성을 유지한다.
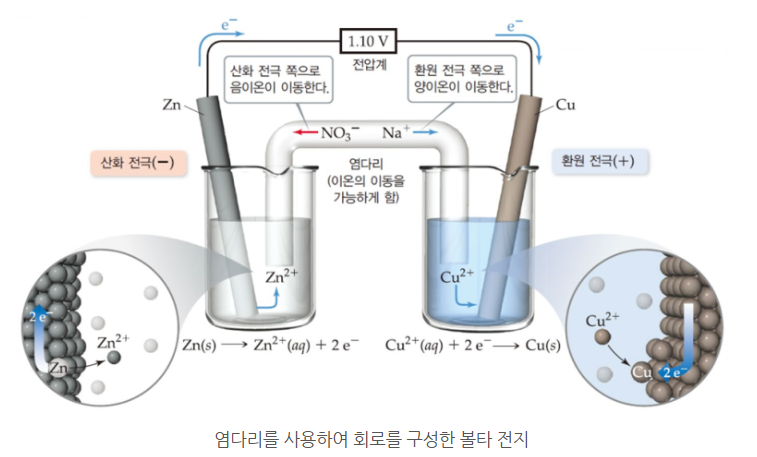
◈ 왼쪽 전극에서는 산화반응(전자 2개 잃음), 오른 쪽 전극에서는 환원반응 (전자 2개 얻음)이 동시에 일어나며, 전자는
외부 회로를 통해 이동하게 된다.
염다리 - NaNO3는 Na+와 NO3-로 이온화되는데 왼쪽 전극에서 산화반응이 일어나서 전자는 외부 회로를 통해 이동
하게 되므로 전기적으로 + 전하이고 이때 전기적 중성을 유지시키기 위해 NO3- (음이온)이 이동을 한다. 반대쪽 (오른
쪽)에서도 마찬가지 반응이 일어난다.
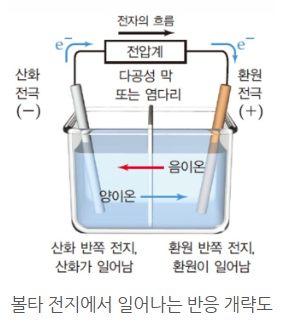
◈ 두 반쪽 전자가 다공성 유리판이나 염다리로 분리되어 있다.
② 다니엘 전지 : 분극현상이 나타나는 볼타전지의 단점을 보완하여 개발
(-) Zn Ⅰ ZnSO4 Ⅰ CuSO4 Ⅰ Cu(+), E° = 1.1 V
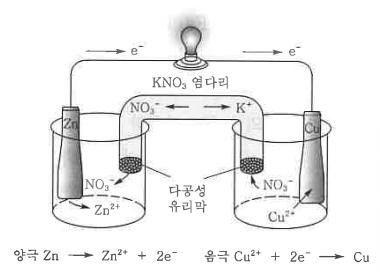
㉠ (-)극 아연판 : 질량 감소 : Zn → Zn2+ + 2e- (산화)
㉡ (+)극 구리판 : 질량 증가 : Cu2+ + 2e- → Cu (환원)
㉢ 전체 반응 : Zn + Cu2+ → Zn2+ + Cu
③ 건전지
(-) Zn Ⅰ NH4Cl Ⅰ MnO2, C(+), E° = 1.1 V
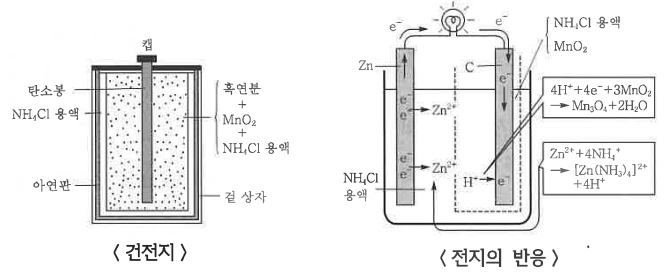
㉠ (-)극 아연 : Zn → Zn2+ + 2e- (산화)
㉡ (+)극 탄소 : 2NH4 + 2e- → 2NH3 + H2 (환원)
※ 건전지에서 NH4Cl은 전해질, MnO2는 감극제로 사용
④ 납축전지
(-) Pb Ⅰ H2SO4 Ⅰ PbO2, E° = 2.0 V
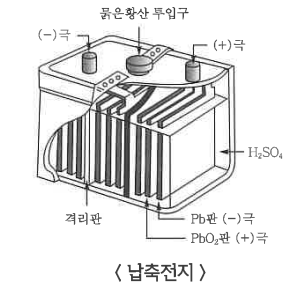
㉠ (-)극 (Pb판) : Pb(s) + SO42- (aq) → PbSO4 (s) + 2e- (산화)
㉡ (+)극 (PbO2판) : PbO2 (s) SO42- (aq) + 4H+ (aq) + 2e- →
PbSO4 (s) + 2H2O (l) (환원)
㉢ 전체 반응
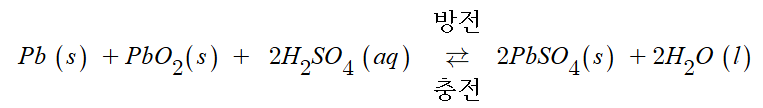
이와 같이 납축전지는 충전과 방전이 가능한 2차 전지이다.
반면 건전지와 같이 충전이 어려운 전지를 1차 전지라 한다.
⑤ 전기분해
▣ 전해질 수용액이나 용융 전해질에 직류 전류를 통하면 그 전해질은 두 전극에서 화학변화를 일으킨다.
이를 전기분해라 한다.

그러나 이온화 경향이 큰 이온이나 몇 가지 원자단은 방전하기 어려워 대신 수용액 중 H+ 이나 OH- 이 방전한다.
(K, Na, Ca, Ba, SO4, CO3, PO4, NO3은 방전하기 어렵다)
㉠ 소금물의 전기 분해
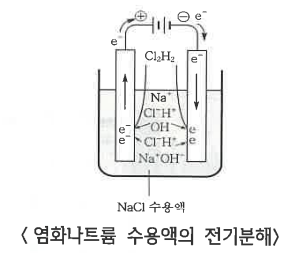
◈ 소금물 : NaCl + H2O → Na+ + Cl- + H2O
(-)극 : 이온화 경향이 작은 것이 석출
2H2O (l) + 2e- → H2 (g) + 2OH- (aq-)
(+)극 : 원자단과 아닌 것이 있으면 아닌 것이 석출,
같은 원자단이면 OH- (O2↑)이 석출
2Cl- (aq) → Cl2 (g) + 2e-
<전체반응> 2Cl- (aq) + 2H2O (l) → Cl2 (g) + H2 (g) + 2OH (aq)
ex : ⅠA 족 (Na, K), ⅡA 족 (Ca) 등은 물과 반응한다.
㉡ CuSO4 용액의 전기분해
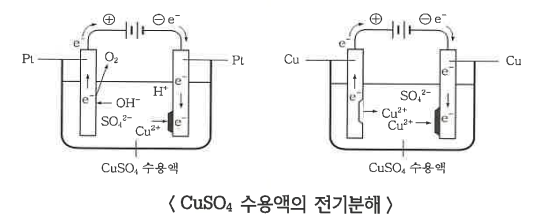
◈ CuSO4 → Cu2+ + SO4
(-)극에서는 Cu2+이 방전되어 Cu로 극판에 석출된다.
Cu2+ + 2e- → Cu
(+)극에서 SO42-은 방전되지 않고 이 이온의 작용으로 구리판이 산화된다.
Cu - 2e- → Cu2+
두 극을 백금(Pt)을 사용하면 (-)극에서는 구리가 석출되고, (+)극에서는 SO42-이 방전되지 않고 물이 방전되어
산소 (O2)가 발생하는 것은 묽은 H2SO4 용액을 전기분해할 때 (+)극에서 일어나는 방전과 같다.
2 H2O - 4 e- → 4 H+ + O2 ↑
마. 페러데이 법칙
① Q = it
여기서, Q : 통해준 전기량 (쿨룽), i : 전류 (Ampere), t : 통해준 시간 (sec)
[제1법칙] 같은 물질에 대하여 전기분해로써 전극에서 일어나는 물질의 (화학변화로 생긴) 양은 통한 전기량에 비례한
다.
[제2법칙] 일정한 전기량에 의하여 일어나는 화학변화의 양은 그 물질의 화학당량에 비례한다.
② 전기량의 단위 : 전기량은 전류의 세기 (Ampere)에 전류가 통과한 시간을 곱한 값과 같다.
1A의 전류가 1초 동안 흐른 전기량을 1 C(쿨룽)이라 한다.
i (A)의 전류가 t초 동안 흐르는 전기량 Q는 다음과 같이 표시한다.
Q [C] = i [A] × t [sec]
5 [A]의 전기량이 한시간 동안 흐른 전기량은 다음과 같다.
Q = 5 × 3,600 = 18,000 [C]
▣ 각 극의 석출량 :
⊙ 전자 1[mol], 1 [F], 96,500 [C]의 전하량 = 1.6 × 10-19C/개 × 6.02 × 1023 개 / mol : 1g 당량
⊙ 농도, 온도, 물질의 종류에 관계없이 1패럿, 즉, 96,500 [C]의 전기량으로 1g 당량의 원소가 석출된다.
#전기분해 #볼타전지 #다니엘전지 #이온 #납축전지 #산화반응 #환원반응 #산화제 #산화수 #환원제
#아연 #구리 #염화나트륨 #페러데이