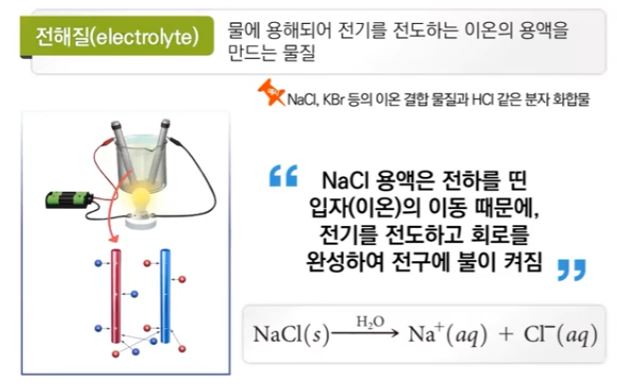
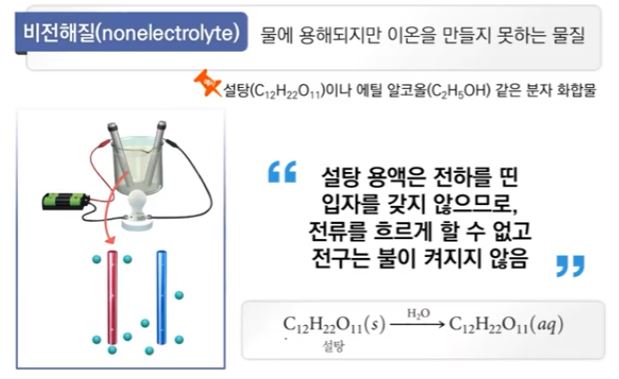
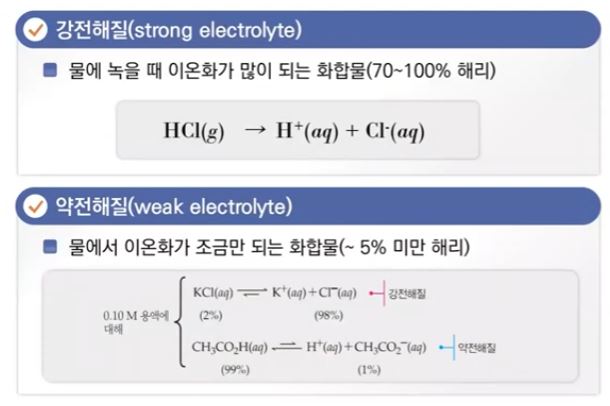
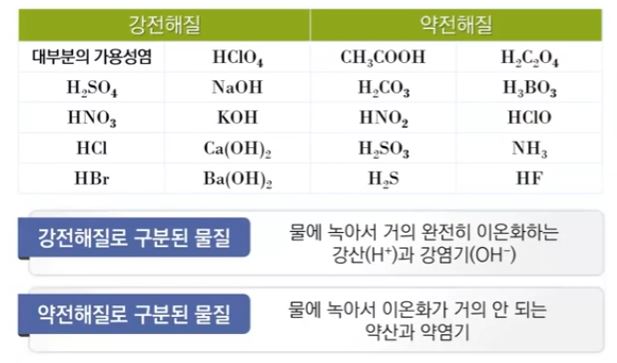
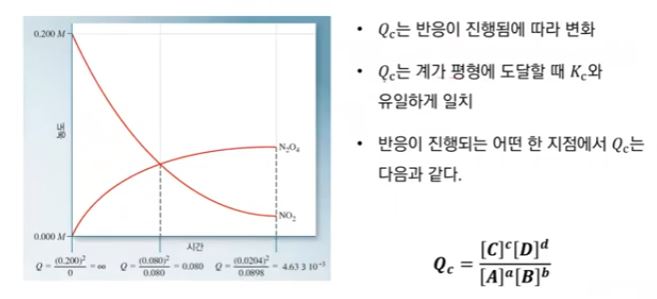
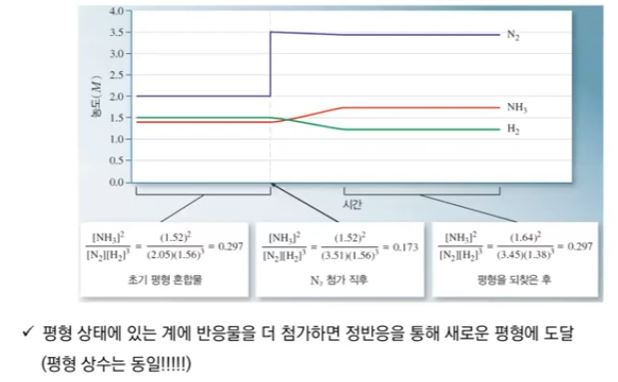
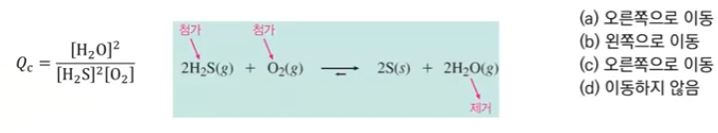
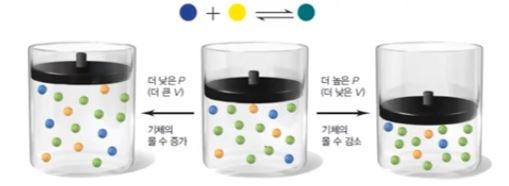
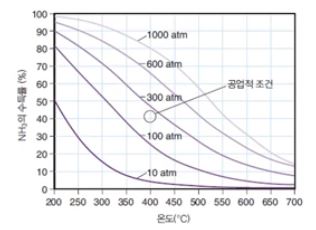
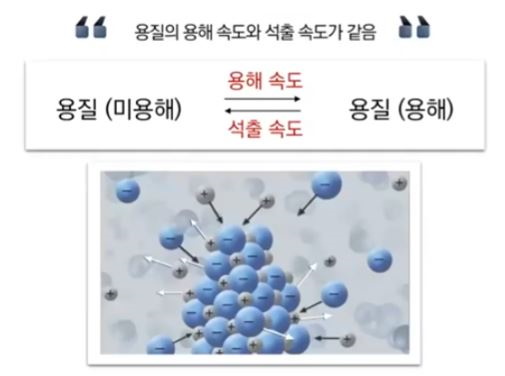
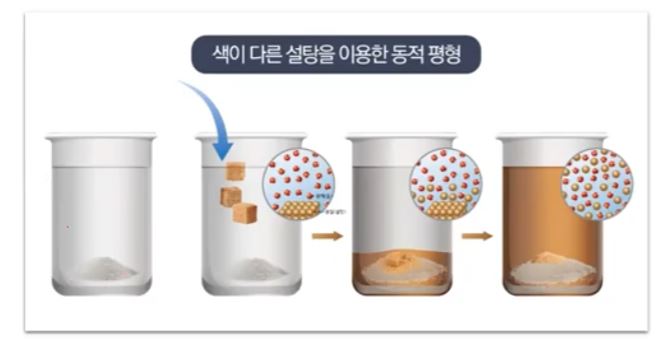
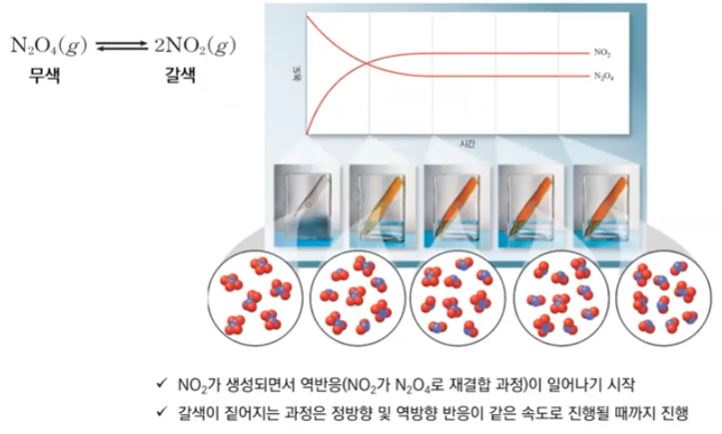
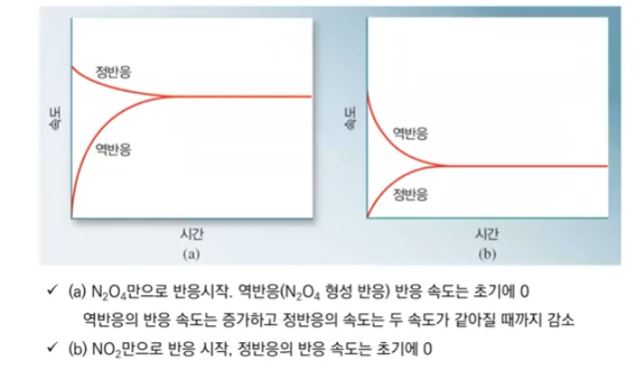
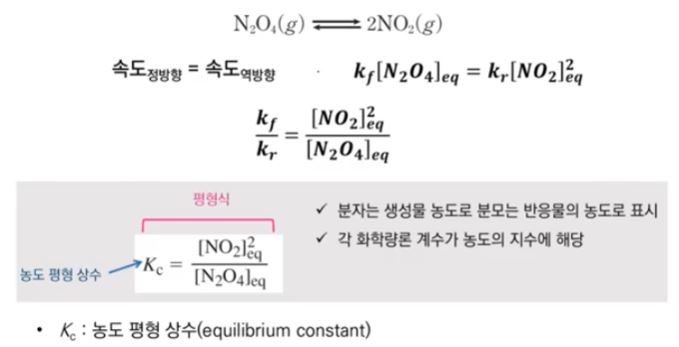
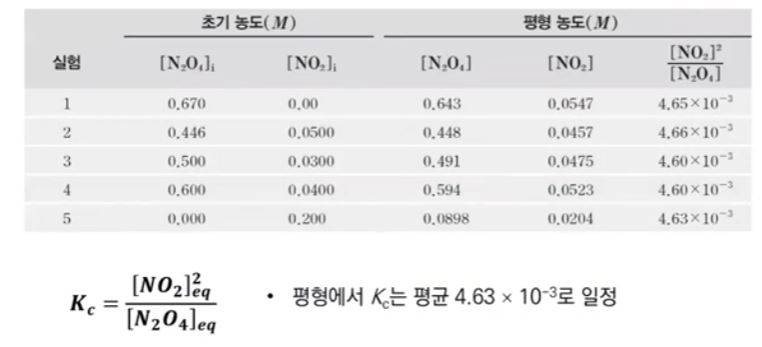
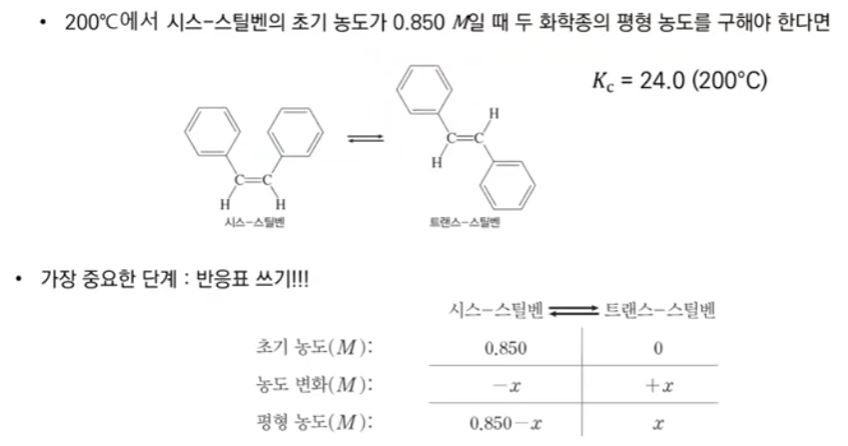
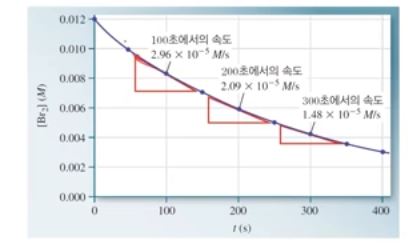
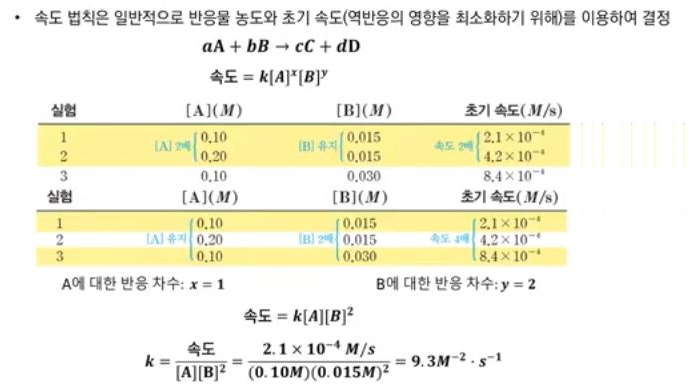
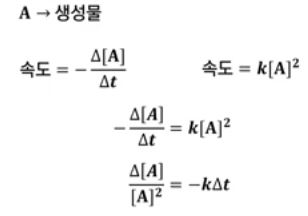
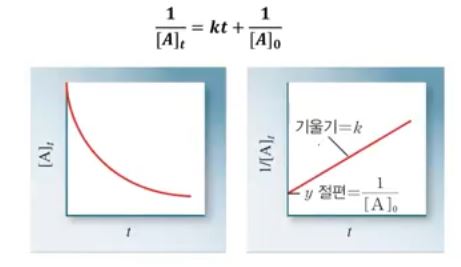
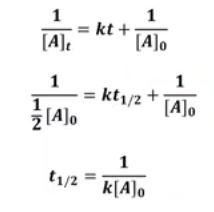
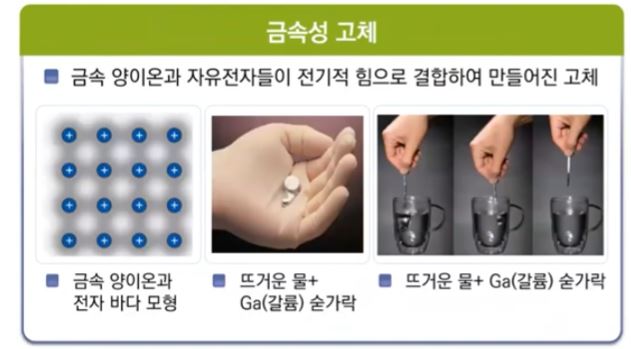
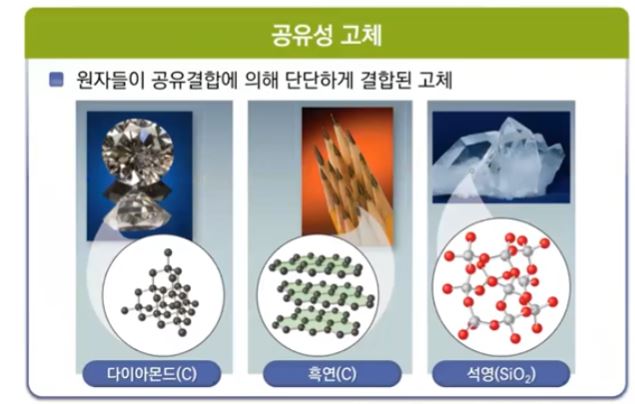
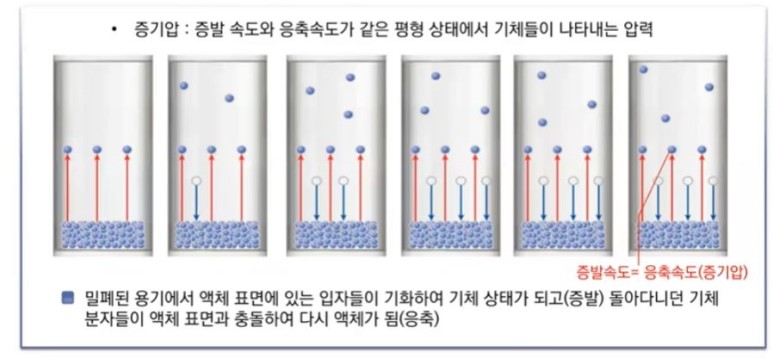
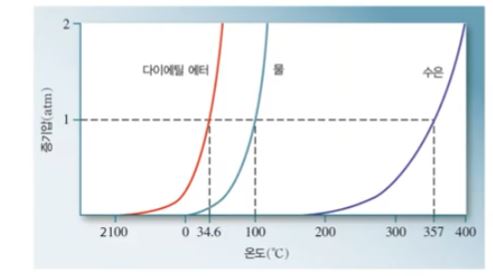
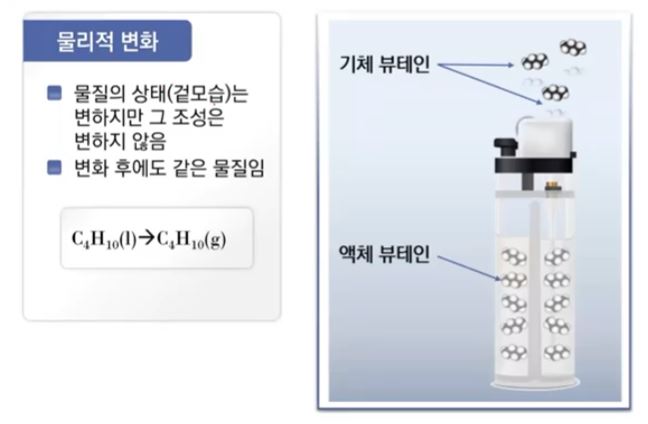
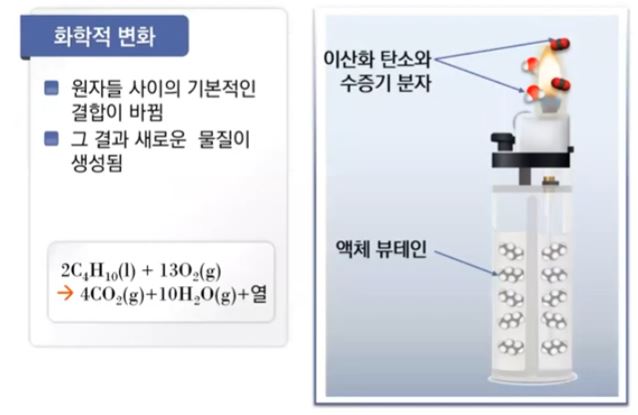
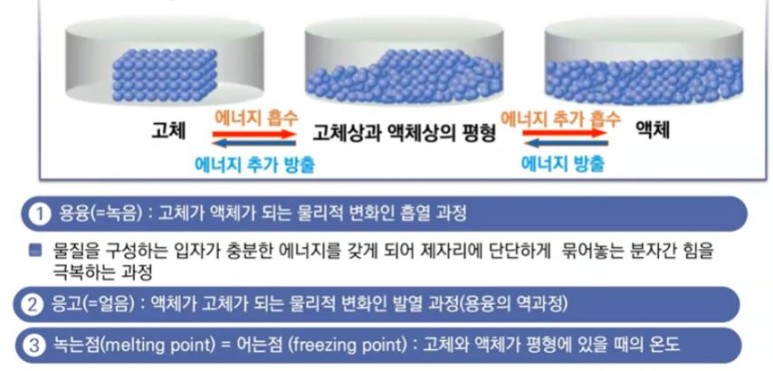
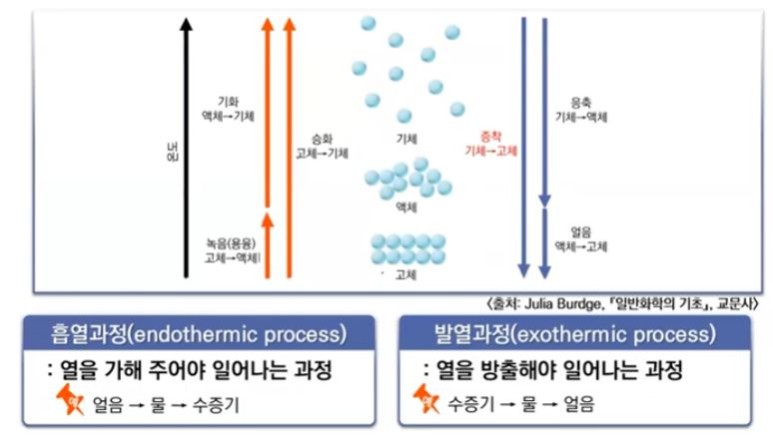
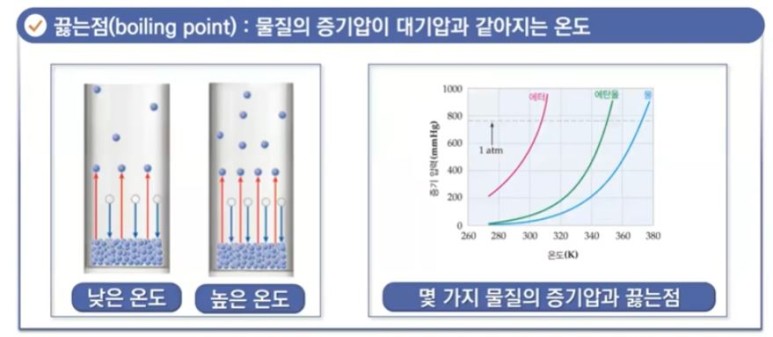
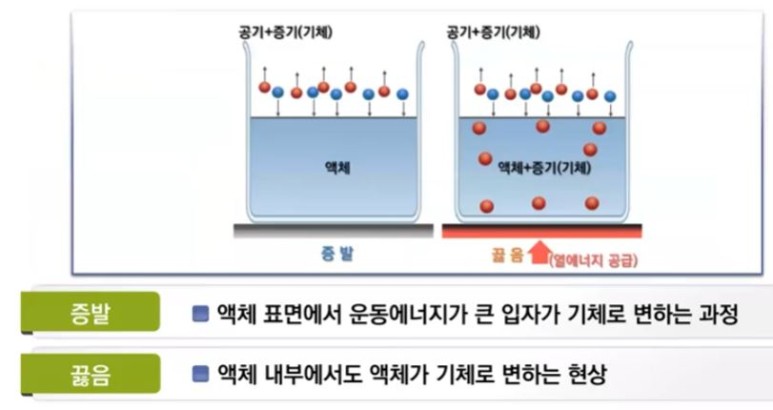
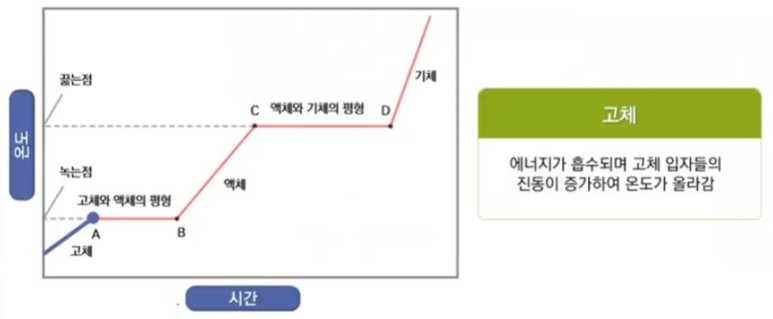
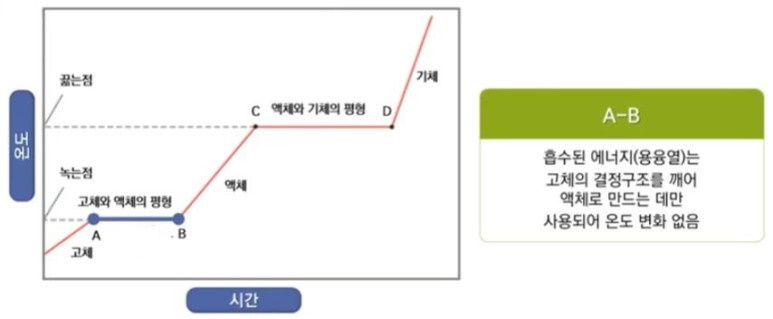
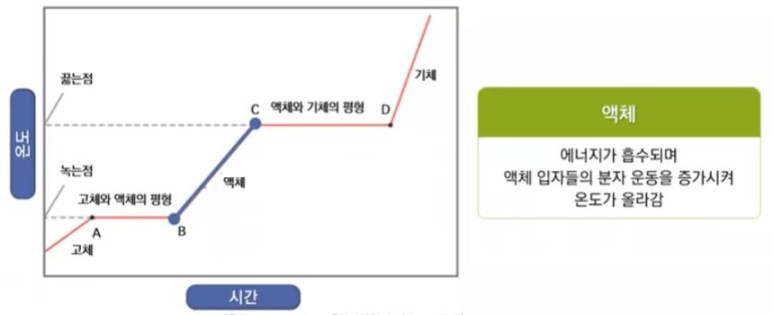
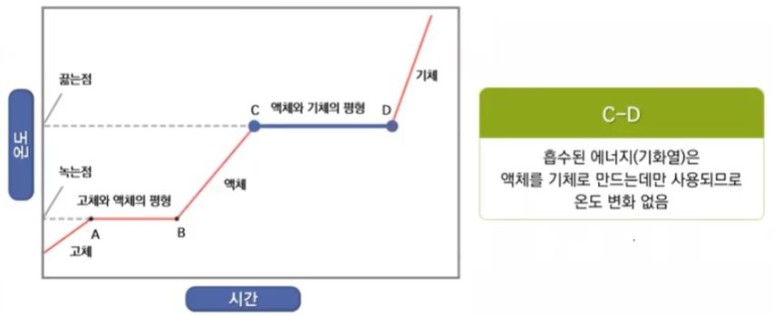
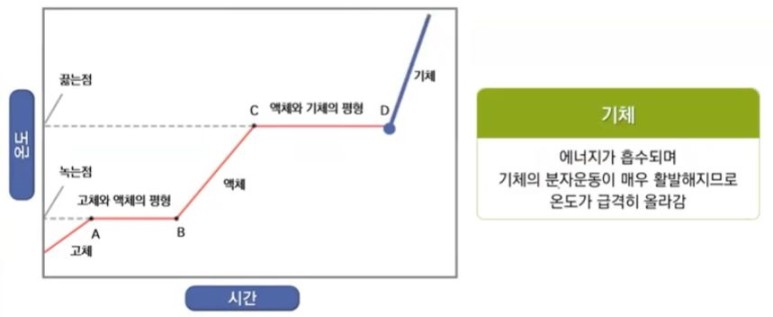
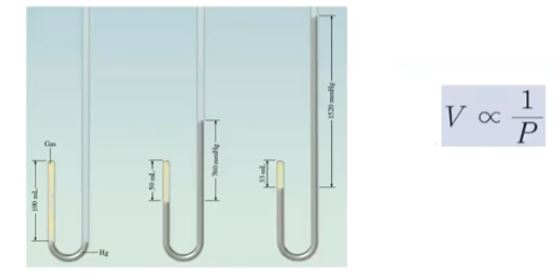
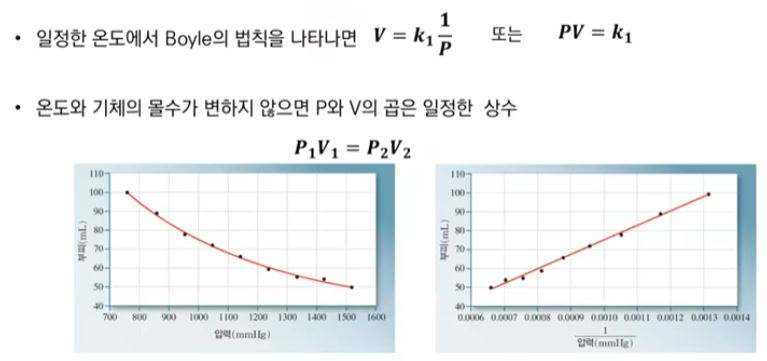
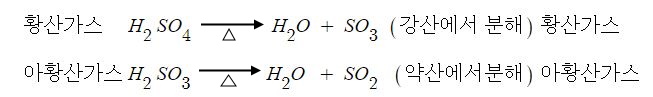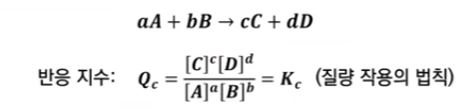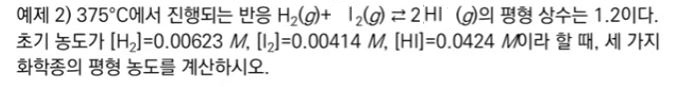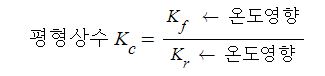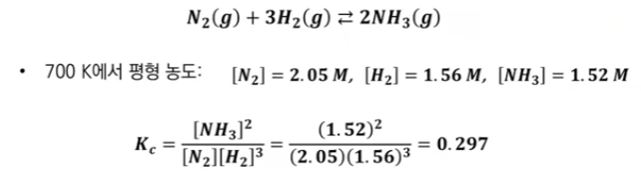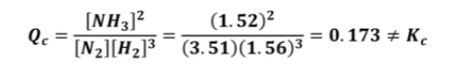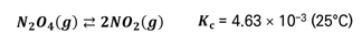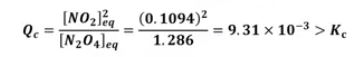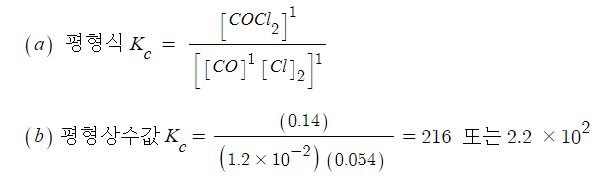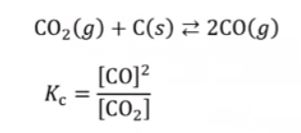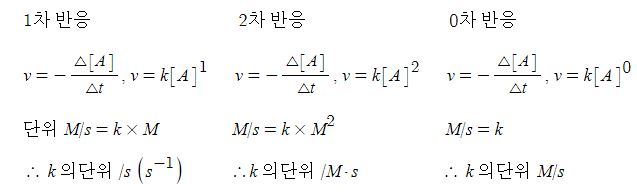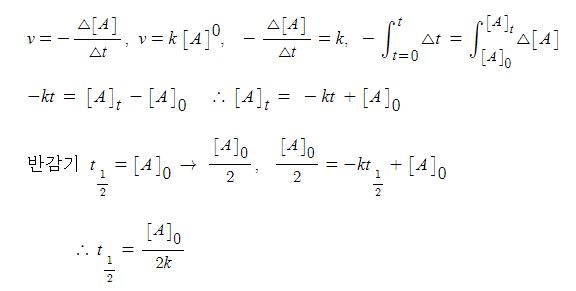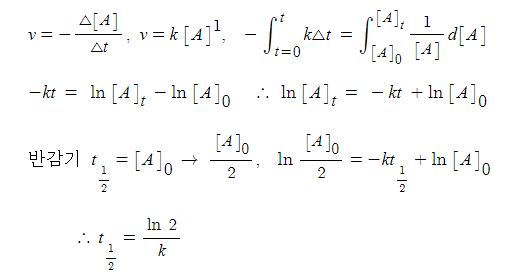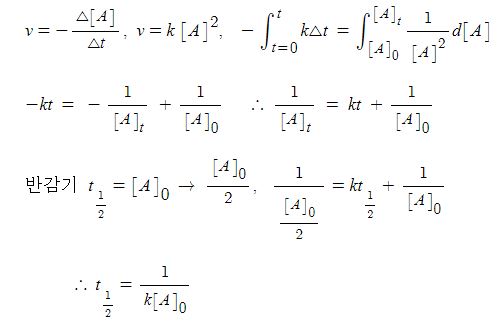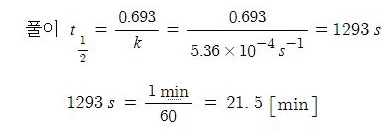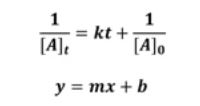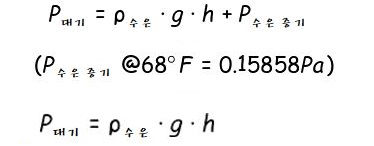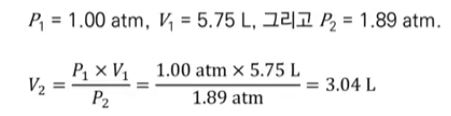【 목 차 】
1. 약산의 이온화 평형
2. 약염기의 이온화 평형
3. 짝산 - 짝염기의 이온화 평형
4. 완충용액
5. 산 염기의 적정
1. 약산의 이온화 평형
가. 산 이온화 상수, Ka
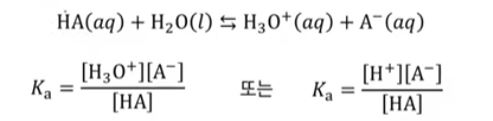
▣ Ka는 산 이온화(해리) 평형상수 (acid ionization constant)
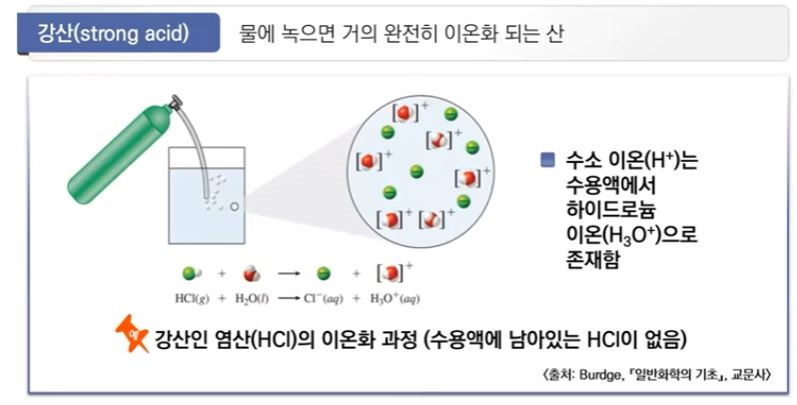
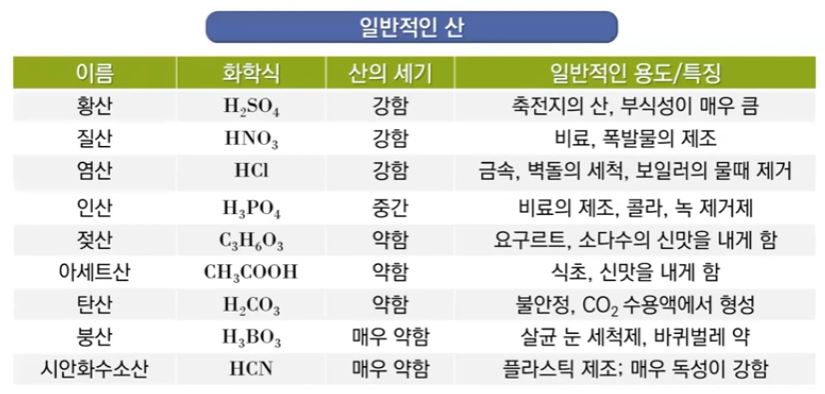
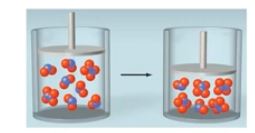
▣ 대부분의 산은 약산 (weak acid)으로 물에서 작은 비율로만 이온화된다.
▣ 평형상태에서 약산의 수용액은 이온화되지 않은 산 분자(대부분)과 약간의 하이드로늄
이온 및 약산의 짝염기로 구성된다.
▣ 약산이 이온화 되는 정도는 산의 농도(Concentration)와 이온화에 평형상수 (equilibrium constant),
즉 산 이온화 상수(Ka)에 의존한다.
▣ 산은 산의 acid 때문에 HA라고 쓴다. 왜냐면 산은 물에 녹아서 H+가 나올 것이고
acid는 여기서 A- 이렇게 쓰고 산이 H+를 내놓아 H3O+가 되고 A- 가 이 산의 짝염기가 된다.
순수한 액체는 활동도가 "1"이기 때문에 평형상수식에 넣지 않는다. 그러므로 이온화되는
반응의 평형상수는 Ka라고 쓰는 이유는 acid 즉, 산이 이온화되는 반응의 K 평형 상수라는 것을
표현하기 위해 Ka라고 쓴다.
평형상수식에서 분모가 HA이고 분자가 H3O+가 되고 A-로 이온화되는 과정이라고
생각하면 된다. 산의 이온화 상수 Ka는 분모에 HA 그리고 H3O+가 분자가 된다. 이렇게
하이드로늄 이온상태로 존재하지만 H+라고 써도 상관없다. A-라고 쓰면 되는 것인데
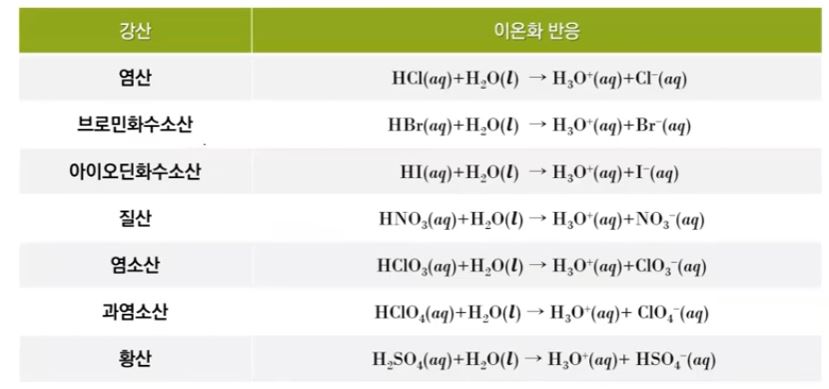
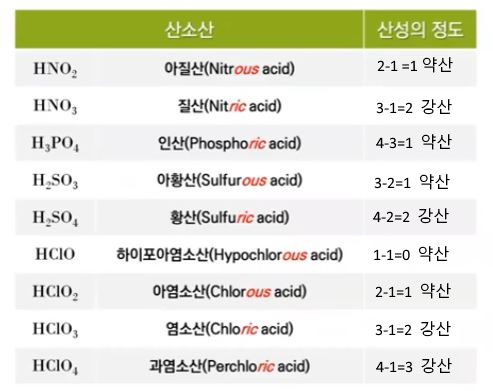
이 때 Ka를 산의 이온화 해리 상수라고 한다. 산은 대부분 강산 족보만 외웠는데 강산을
외울 수 있도록 반복하겠다. 즉 HCl < HBr < HI 이 3개는 강산이고 그 다음 산소 개수 빼기
수소개수가 2보다 크거나 같은 경우 강산이다. 이 족보에 들어가지 않은면 모두 약산이다.
그래서 약산의 종류가 몇 천가지 이상으로 많다. 약산은 물에서 아주 작은 비율로만 이온화되니까
정반응, 역반응이 모두 일어 나므로 평형상수를 쓸 수 있다.
실제 평형상수 상태에서 약산의 수용액은 거의 이온화가 안되고 약산 물질로 남아 있기
때문에 약간의 아이드로늄 이온 그리고 약산의 짝 염기로 구성된다. 약산의 이온화 정도는
산의 농도와 이온화에 대한 평형상수 즉, 산의 이온화 상수에 의존한다.
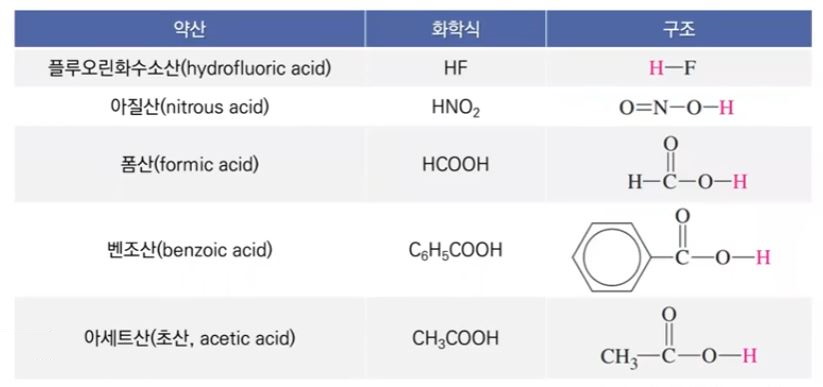
▣ 일반적으로 널리 사용되는 약산들의 25[℃]에서 이온화 상수
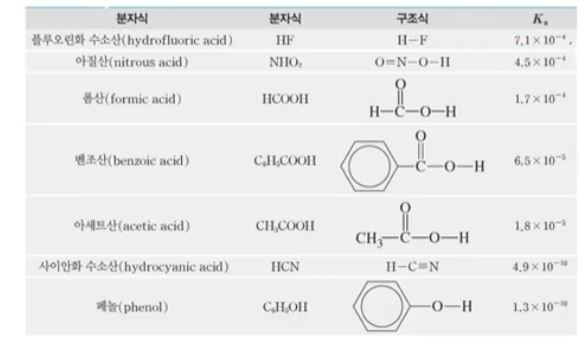
▣ 이온화 상수 값이 크다는 것은 산(H3O+ + XF-) / HF 의 경우 다른 산 보다 값이 크다.
Ka 값이 크다는 것은 분자가 크다는 것이고 이는 곧 H+가 많이 나온다는 것이다.
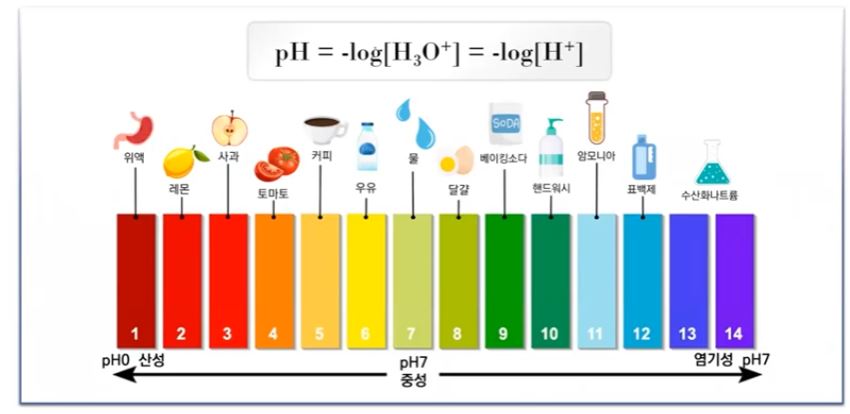
▣ 산의 이온화 상수가 크면 클 수록 산성이 강하다.
나. Ka를 이용한 PH 계산

▣ 산 물질의 경우 PH 계산하는 것이 가장 기본이고 중요한 문제이다. 상온(25[℃])에서
0.005 M 농도 HF 용액이 있다. 이 용액의 PH를 계산하라는 문제이다.
HF의 이온화 상수 Ka = 7.1 × 10-4 로 주어졌다. 그런데 불산(HF)이 0.5 M농도다.
이 물질이 반응하여 X 만큼 없어지고 일대일로 반응하여 F도 X만큼 생긴다.
따라서 0.5 - X = (X) (X) 로 계산하게 된다.

위 식은 원래 이차방정식의 근의 공식으로 풀어야 하는데 x2이 0.5가 분자에 곱해지면
7.1인데 0.5가 곱해지니까 3×10-4가 된다. x2이 10-4이니까 x는 10-2가 될 것이고
그렇게 생각하면 0.5보다 약간 작을 것으로 추정된다. 따라서 단순화 계산법 또는 근사
법이라고 한다. Ka값이 작다면 곱해진 상수를 생각해서 x2의 값을 예측했을 때 그 값은
10-2 가 되어 0.5보다 5[%] 보다 작을 것 같다는 확신이 든다면 0.5 - x를 0.5로 쓸 수
있을 것이다. x를 구해 보면 1.9 × 10-2 이다. 1.9 × 10-2 값은 계산해 보면 거의 같다.
다. 단순화 계산 (근사법)
▣ 단순화 계산법 (5% rule)은 x의 크기가 산의 초기농도의 5[%] 보다 작을 때 사용 가능
▣ 실제로 x의 계산된 값이 초기 산 농도의 5[%] 보다 작으면 이차방정식 근의 공식을 사
용한 것과 차이가 거의 없음
▣ 초기 농도가 높을 경우 (0.5M)일 때는 단순화 계산이 가능하나 초기 농도가 낮은(0.050 M) 경우 사용 불가능

▣ 일반적으로 농도가 묽은 용액일 수록 이온화 정도가 더 크다.
▣ 근사값으로 계산한 때와 근의 공식으로 푼 것과 값이 거의 유사하다.
앞에서 x 값이 1.9 × 10-2 이니까 HF 값이 0.48 남아 있고 H3O+ 와 F-는 0.019이니까
-log를 붙여서 PH값은 1.72이다. 이렇게 계산할 수 있다.
▣ 단순화 계산법에서 제일 중요한 것은 변화량 x의 크기가 산의 초기 농도의 5[%] 보다
작을 때만 쓸 수 있다. 그런데 0.05 M인 HF 묽은 용액에 대하여 x를 풀면 6.0 × 10-3
M이 된다. 이는 12[%]가 되므로 근사법을 사용할 수 없다.
라. Ka를 이용한 PH 계산
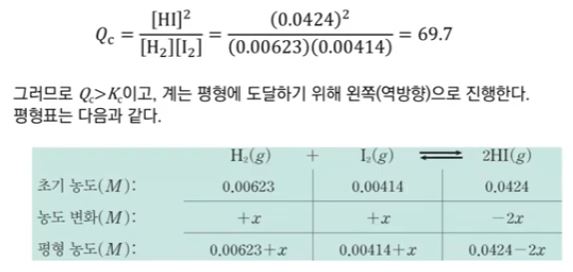
예제) 아이포아염소산 (HClO)의 Ka는 3.5 × 10-8 이다. 25[℃] 에서 0.0075 M인 HClO
용액의 PH를 계산하시오.
▣ 평형문제는 반응표를 쓰는 것이 중요하다.
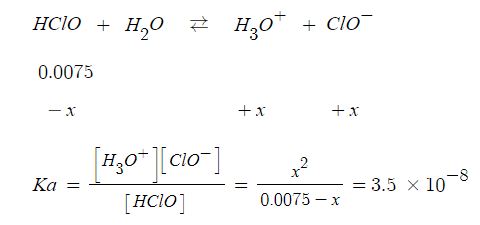
Ka는 약 7.5 × 10-3 정도가 된다. 이는 x 값이 매우 작을 것이라고 생각된다.
|
|
HClO (aq) + H2O (l) ↔ H2O (aq) + ClO (aq)
|
|||
|
초기농도
|
0.0075
|
-
|
0
|
0
|
|
농도변화 (M)
|
-x
|
-
|
+x
|
+x
|
|
평형농도 (M)
|
0.0075-x
|
-
|
x
|
x
|
계산하면 다음과 같다.
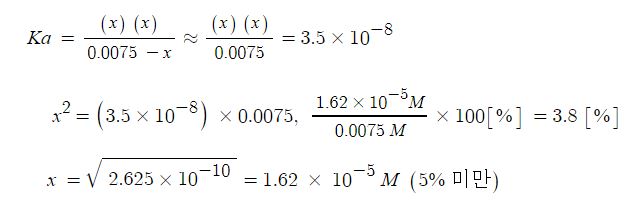
마. PH를 이용한 Ka 계산
▣ 약산 용액의 PH를 사용하여 Ka의 값을 결정할 수 있음
▣ 어떤 약산 HA 0.25 M 용액의 PH가 25 [℃]에서 3.47 일 때 이 약산의 Ka를 구하시오.

▣ 이 약산의 Ka는 4.6 × 10-7 이다.
▣ H3O+의 농도는 10-PH 이니까 10-3.47 = 3.39 × 10-4 [M] 이다.

[풀이]

2. 약 염기의 이온화 평형
가. 염기 이온화 (해리) 상수 Kb
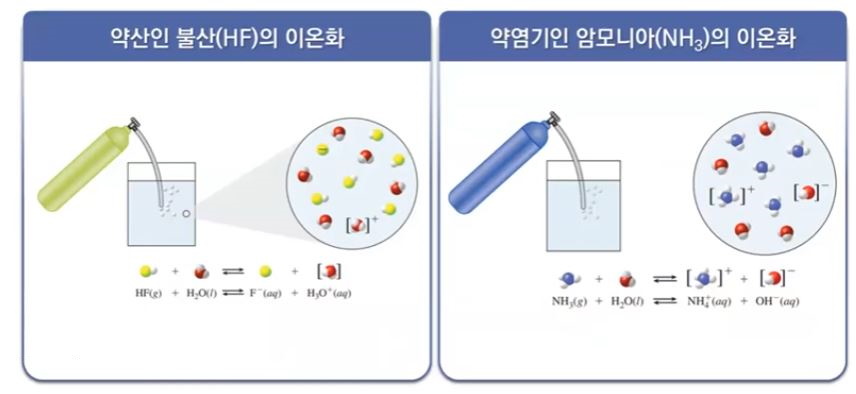
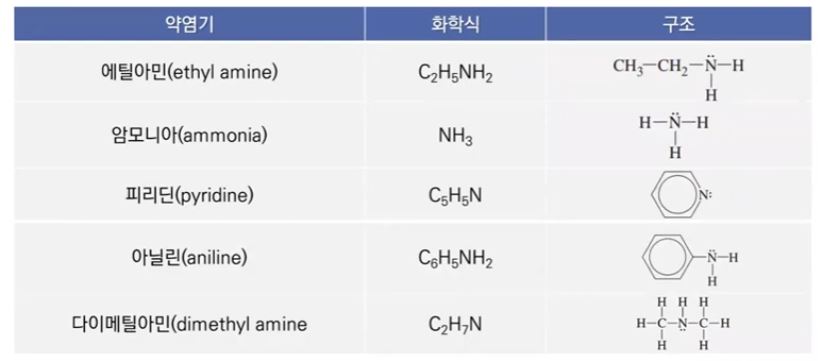
▣ 약 염기의 이온화는 다음 식으로 나타낼 수 있음
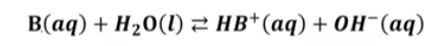
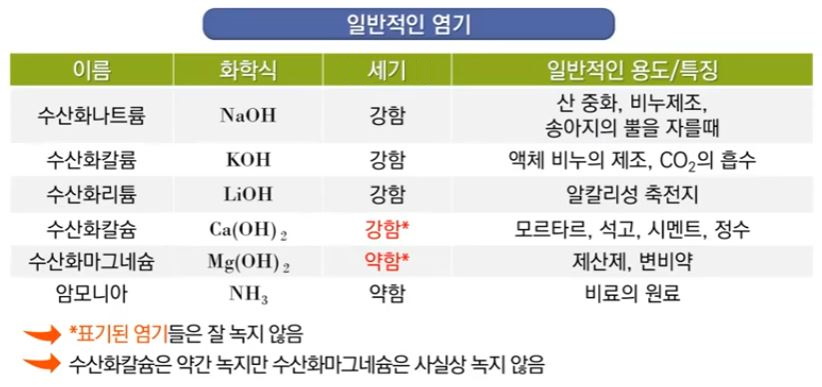
▣ 약염기 (weak base)의 이온화는 불완전하고 약산의 이온화와 같은 방식으로 처리
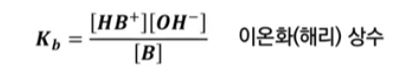
▣ 약염기는 약산의 식을 똑 같이 쓸 수 있다.
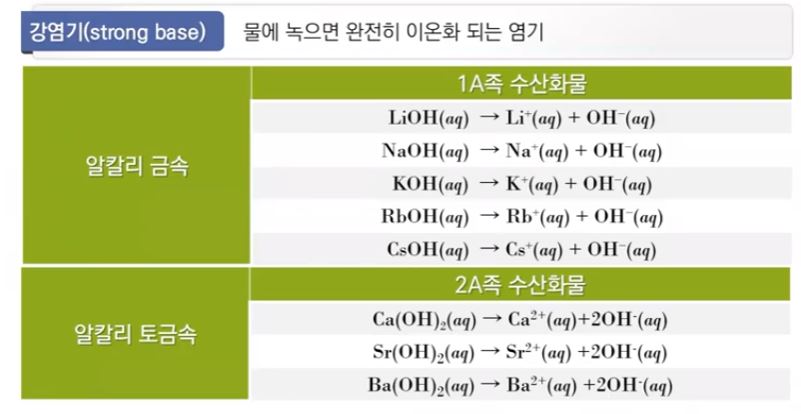
▣ 염기는 H+를 받을 수 있는 물질이다. H+를 받아서 HB+가 됐고 물에서 H+를 냈으니
물은 OH-가 된다. 따라서 염기의 해리, 이온화 상수는 염기 농도는 이 물질은 순수한
액체이니까 활동도가 "1"이라서 안써도 된다.
이렇게 하여 염기농도 Kb = ([HB+] [OH-]) / [B] 이것이 염기의 이온화 상수이다.
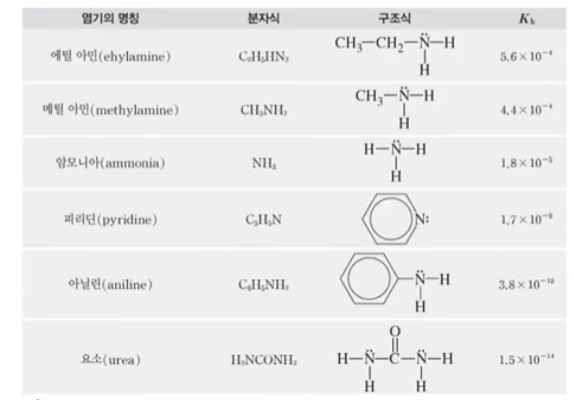
▣ 일반적으로 널리 사용되는 약 염기들의 25[℃]에서 이온화 상수
나. Kb를 이용한 PH계산
예제) 25[℃]에서 0.040 M 암모니아 용액의 PH를 구하시오. (단, NH3의 Kb = 1.8 × 10-5)
[풀이]
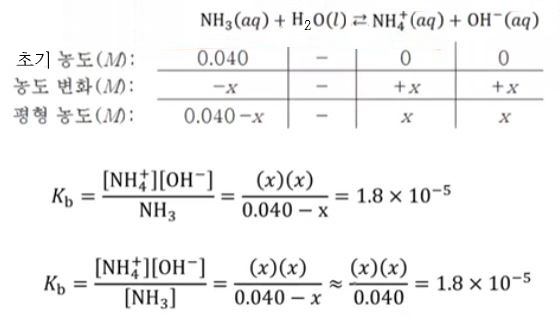
[풀이]

3. 짝산-짝염기의 이온화 평형
가. 짝산-짝염기 쌍의 Ka와 Kb의 관계

▣ 약산이 있다. 약산은 이 HA이다. 약산이 이온화되어 짝 염기 A-가 나오고 이 짝염기는
물에 넣었을 때 물에서 H+를 받아서 다시 약산 HA로 복귀한다. 결국 짝 염기는 물에 녹
으면 다시 약산 HA로 회복이 된다. 따라서 어떤 산과 이 산의 짝 염기, 이 둘의 이온화식
2개를 더하면 물 2개가 H+와 OH-로 해리되고 합은 물이 이온화 되는 것이다.
위의 오른쪽 식은 약 염기가 이온화되는 과정을 나타낸 것이다. 물에서 H+를 받아서
HB+가 되고 OH-를 만들었다. 따라서 이 염기의 짝산이 된다. 이 짝산이 이온화되는 것
을 쓰면 짝산이 원래대로 회복하는 것이 된다.
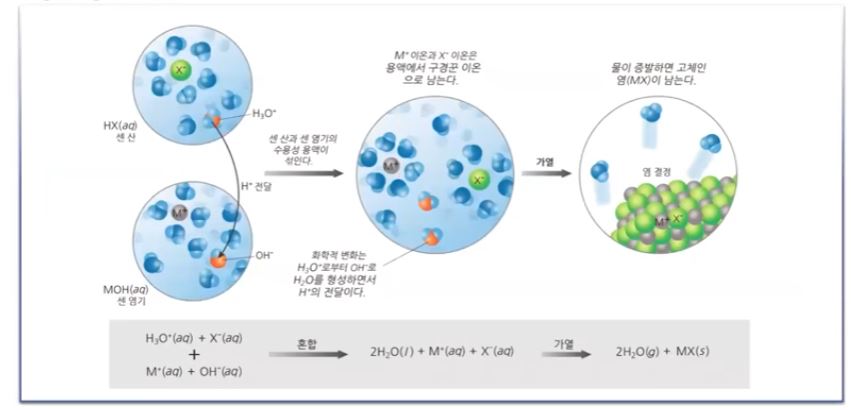
이 둘을 합하면 자동 이온화가 되고 Ka × Kb = Kw 가 된다.
어떤 산 그리고 그 산의 짝염기 산의 이온화 상수, 짝 염기의 이온화 상수를 곱하면
항상 물의 이온곱 상수인 1 × 10-14이 된다. 그러므로 기본적으로 산의 Ka값과 염기의
Kb를 곱하면 1 × 10-14 이다.
4. 완충용액
가. 공통이온효과 (아세트산과 아세트산소듐의 혼합용액)
▣ 아세트산은 CH3COOH, CH3CO2H로 쓴다. 아세트산 소듐은 아세트산에서 H가 떨어
지고 대신에 Na+가 붙은 것이다. CH3COONa이다. 용해도 규칙에서 강조했듯이 일단
Na가 있다는 것은 CH3COO-와 Na+가 있는데 Na가 있으면 100[%] 이온화 된다.
1족 원소와 암모늄이 있으면 무조건 100[%] 이온화 된다. 따라서 CH3COONa는
100 [%] 이온화 된다.
▣ 공통이온효과는 예를 들어 하나의 플라스크 안에 아세트산 100개와 아세트산 소듐
100개를 넣게 되면 다음과 같이 이온화된다.
CH3COONa → Na+ + CH3COO-
화살표 하나로 쓴 것은 100[%] 이온화 되기 때문이다. 똑같은 물에 지금 똑같은 플라
스크 속에 아세트산이 있다.
CH3COOH + H2O ↔ H3O+ + CH3COO- 가 생긴다.
여기에서 공통 이온효과라는 것은 원래 아세트산은 물에 잘 녹지 않는다.
만약 아세트산을 10개 중에 20개가 이온화되고 80개가 남아 있는 것이 정상인데 약산인
아세트산은 같은 플라스크 내에 아세트산나트륨이 들어가 있어서 Na는 100[%]
이온화 되므로 아세트산도 100[%] 이온화 되어 버린다. 아세트산이 쪼개져서
CH3COO- 를 만들려면 원래 80개는 이온화되지 않고 20개만 이온화되는데 플라스크
안에 이미 100개의 CH3COO- 가 있어서 아세트산은 20개만 있고 싶은데 100개는
아세트산 입장에서는 너무 많이 이온화된 것이다. 이런 경우 르샤틀리에 원리에 의해서
플라스크 안에 CH3COO- 가 너무 많으니까 플라스크에 남아 있을 수가 없어서 이온화가
어떤 식으로 변하는가 하면 아무 것도 없었다면 이온화될 20개가 공통 이온 즉,
CH3COO- 가 너무 많으니까 역반응을 많이 하게 된다. 원래 20개가 이온화가 되려하고
역반응이 훨씬 많이 일어나게 되어 CH3COOH 는 99개 남아 있고 H3O+와
CH3COOH- 는 1개씩만 발생하게 된다. 따라서 완충용액을 만들면 플라스크에 넣은
산이 그대로 남아 있게 된다. 짝염기도 100[%] 이온화되니까 그대로 99개가 남아 있으니
100개가 있는 것이나 거의 마찬가지이다. 이 용액에 H3O+ 염산을 10개를 떨어뜨리면
이 H+는 CH3COO- 와 바로 결합을 하여 CH3COOH로 변한다. 이렇게 CH3COO-가
용액 속에 남아 있지 못하게 한다. 이렇게 바로 바로 이온화 되지 않은 상태로 회복시키니까
산을 첨가해도 줄어들지 않는다. H+ 개수가 많아지면 PH가 줄어 들어야 하는데
이 경우는 줄어들지 못한다. 그럼 이번에는 위 플라스크에 OH-를 10개 넣었다고 하자.
아세트산은 100개 중에 20개가 이온화되고 80개가 남아 있어야 하는데 그런데 공통
이온 때문에 이온화를 하지 못한다. CH3COOH 는 이온화가 20개가 되어야 하는데
공통 이온 때문에 1개 밖에 못한 상황이었는데 즉, 산이 이온화되고 싶었는데 여기에
OH-가 들어 온 상황이 된다. 그러면 이 산은 바로 이온화 되어 H+ 를 내놓아서 OH-를
없애 준다. 즉, 이 용액에 OH-를 넣던 H+ 를 넣던 PH는 변화가 없게 된다.
이런 현상을 공통 이온효과, 약산과 짝염기를 이용한 공통 이온효과로 PH 변화가 없는
용액을 만들어 (거의 변화가 없는) 아주 미소한 PH 변화를 만드는 것을 완충용액, 버퍼
솔루션이라고 한다.
나. 완충용액
▣ 완충용액 (Buffer solution) : 약산과 그것의 짝염기 (또는 약염기와 그것의 짝산)를 포함한 용액
▣ 완충용액은 혼합물이므로 산이나 염기의 적은 양의 첨가에 의한 PH의 변화에 효과적으로 저항할 수 있음
▣ 아세트산이 1.0 M이고 아세트산 소듐이 1.0 M인 용액에 0.1 [mol]의 HCl을 첨가하는 경우를 가정해 보자.
(용액의 전체 부피는 변하지 않는다고 가정한다.)
⊙ 소량의 산이 첨가되면 강산(H3O+)이 아세트산 이온에 의해 완전히 소모되면서 약산(CH3COOH)으로 전환
H3O+ (aq) + CH3COO- (aq) → CH3COOH (aq) + H2O (l)
⊙ 원래 강산을 넣는 것은 용액의 PH를 감소하게 한다.
⊙ 강산을 약산으로 전환하는 완충 용액의 능력은 PH에 대한 산 첨가의 효과를 최소화

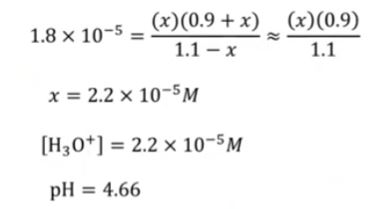
▣ 염산을 첨가하기 전의 PH = 4.74 → 단지 0.08개만 변함
▣ 순수한 물 1[ℓ] 에 HCl 0.10 [mol]을 첨가했다면, PH는 7.00 에서 1.00까지 변했을 것이다.
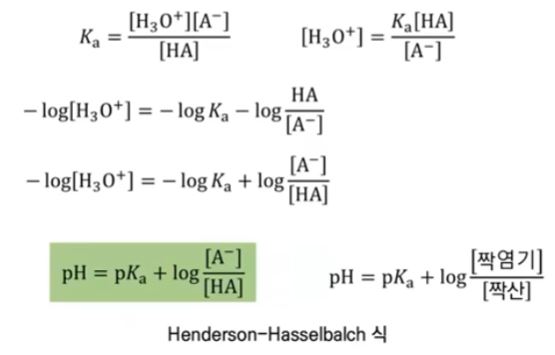
다. 핸더슨 - 하셀 바흐식
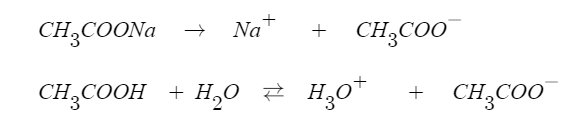
▣ 공통이온이 있으므로 아세트산 (CH3COOH)은 거의 이온화가 되지 않는다. (역반응이
강하게 나타난다) 이 둘은 하나의 비이커에 넣은 것이므로 이용액이 가지는 Ka 즉, 산의
이온화 상수를 쓸 수 있다.
산의 이온화 상수는
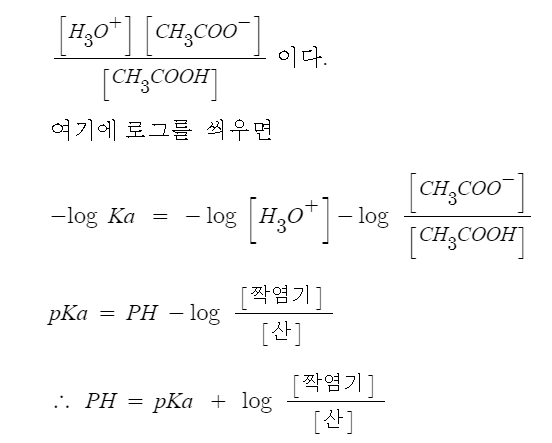
만약, pKa가 5.7인 산을 가지고 산의 비율과 짝염기의 비율을 2 : 1로 했다면
PH는 5.7 - 0.3 = 5.4 가 된다.
▣ 평형식으로 부터 완충용액의 PH를 결정하는 식 유도 가능
예제) 아세트산 농도는 1.00 M이고 아세트산 소듐의 농도도 1.00 M인 완충용액
1.00[ℓ] 로 반응을 시작할 때 NaOH 0.100 [mol]을 첨가한 후의 PH를 계산하시오.
(반응이 용액의 부피를 변하게 하지 않는다고 가정하시오.)
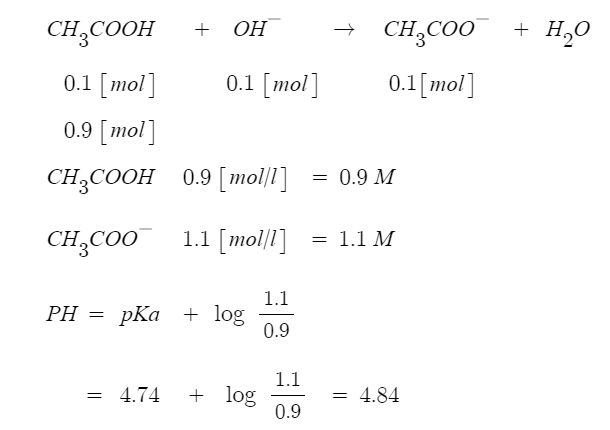
▣ 완충 용액의 조건

⊙ log 항은 -1 부터 1까지의 값만 가질 수 있음
⊙ 완충용액의 PH는 그것이 포함하는 약산의 pKa와 차이가 한 PH단위 (1PH)보다 많을 수 없음
⊙ 완충용액의 범위는 PH = pKa ± 1
⊙ 원하는 특정 PH를 가지는 완충용액을 만들기 위해 우리가 적절한 짝 쌍을 선택 가능하게 함
▣ 첫째, pKa가 원하는 PH와 가까운 약산을 선택
▣ 둘째, 필요한 [짝염기] / [짝산] 의 비율을 얻기 위해 Henderson-Hasselbalch 식에 PH와 pKa 값을 대입
⇒ 이 비율은 완충용액을 만들기 위한 물량으로 전환 가능

5. 산 염기 적정
가. 강산 - 강염기 적정
▣ 산 염기 적정은 농도를 모르는 용액에 농도를 아는 용액을 넣어서 원래 농도가 얼마인지를 알아내는 과정을 말한다.
▣ 0.100[M] NaOH 용액을 0.100 [M] HCl [㎖] 이 들어 있는 플라스크에 넣는다고 가정해 보자.
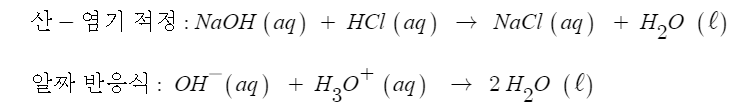
1. NaOH 첨가전
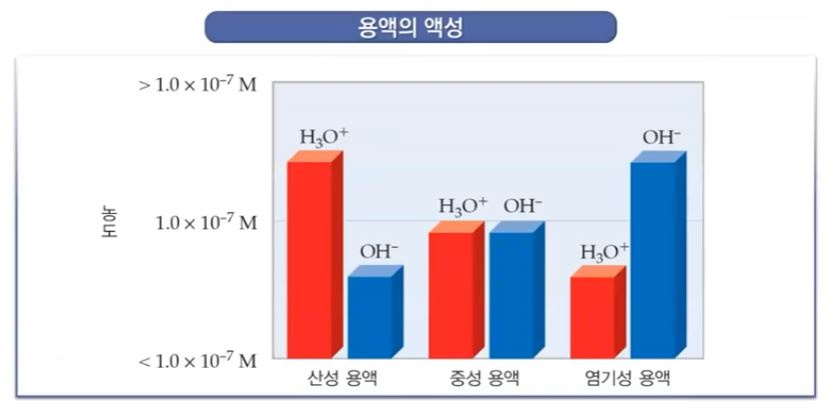
PH = - log [H3O+] = log (0.100) = 1.00
2. 0.100 M NaOH 10.0 [㎖] 를 첨가

▣ 더해진 OH- 의 변화에 따른 산의 변화는 다음과 같다.
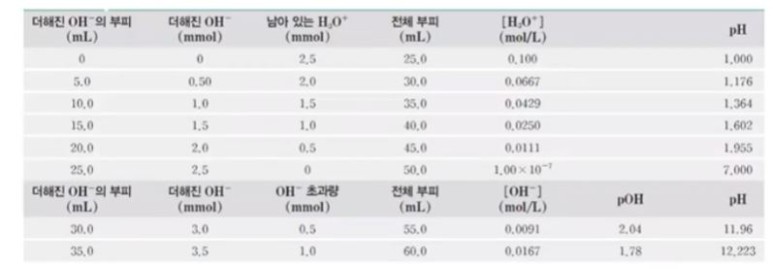
▣ 위 그림에서 OH- 를 더하면 반응을 하여 남아 있는 H3O+ 는 줄어 들게 된다. HCl과 같은 양이 되면
모두 반응을 해서 H3O+ 는 없어지게 되고 이 때의 PH는 7이 된다.
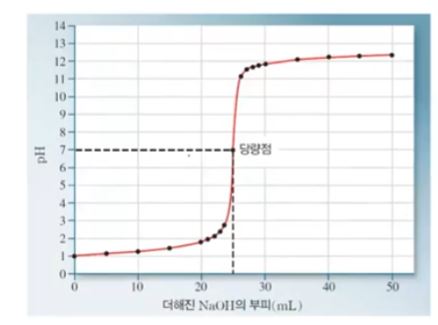
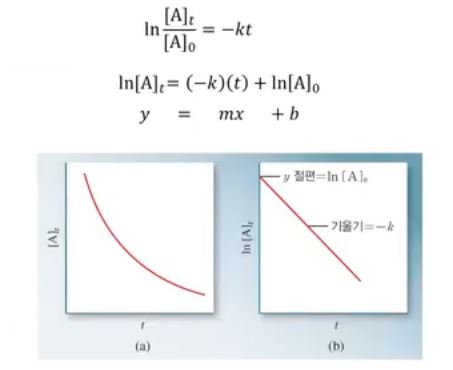
▣ 위 그림은 이를 그래프로 나타낸 것이다.
▣ 강산 - 강염기 적정의 적정곡선 (더해진 적정 제외의 부피 함수로서이 PH)
▣ 적정제인 0.100 M NaOH 은 부렛으로 부터 삼각 플라스크의 0.100 M HCl 용액으로 더해짐
'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 산화 · 환원 반응 - 기초 화학 (0) | 2022.12.15 |
|---|---|
| 엔트로피와 자유에너지 - 기초 화학 (0) | 2022.12.13 |
| 산과 염기 - 기초 화학 (2) | 2022.12.08 |
| 평형상수와 르샤틀리에 원리 - 기초 화학 (2) | 2022.12.06 |
| 가역반응과 화학평형 (0) | 2022.12.05 |