【 목 차 】
1. 산화와 환원
2. 산화수
3. 산화 환원 반응의 종류
4. 산화 환원 반응의 완결
1. 산화 환원 반응
가. 산화 환원 반응의 정의

▣ 산화, Oxidation, Oxygen을 즉, 산소를 추가했다고 생각할 수 있다. 산화는 산소와
결합하는 반응이다. 산소는 전기음성도가 2번째로 세다. 불소(F)가 제일 세고, 산소와
결합하면 산소는 전자쌍을 자기 쪽으로 끌어 당기는 힘이 무척 센 원자이기 때문에
산소에게 전자를 빼앗겼다는 것이다. 산화를 예전에는 산소와 결합에 초점을 두었다면
요즘은 전자를 빼앗기는데 초점을 둔다. 환원은 산화와 완전히 반대되는 개념이다.
결합되었던 전자를 다시 회복하는 반응이다.
▣ 산화, 환원 반응의 동시성은 어떤 물질이 산화되었다는 것은 전자를 빼앗겼다는 이야기
이다. 그럼 전자를 빼앗아간 물질이 있을 것이다. 전자를 내놓는 물질이 있으면 반드시
전자를 얻는 물질이 동시에 그 주변에서 일어 날 수 밖에 없다는 것이다. Na 고체와 Cl2
기체가 만나면 NaCl 고체가 즉 소금이 생기는데 엄청난 양의 빛을 내면서 소금이 생긴
다. 이 때 Na는 전자를 잃고 Cl은 전자를 얻는 즉, Na는 산화되고 Cl은 환원되고 산화
되는 반응을 산화 반쪽 반응, 환원되는 반응만 쓰는 것을 환원 반쪽 반응이라고 한다.
나. 산화제와 환원제

위 그림과 같이 염소기체가 있는 플라스크에 Na 조각을 조금 넣으면 불이 나면서 반응이
잘 된다. 발열 반응을 하고 소듐은 염소기체 한테 전자를 빼앗기니까 염소에 의해서 산화
되고 염소기체는 소듐에 의해서 전자를 얻었으니까 염소기체는 환원된다. Na은 Na+가
되면서 자신은 산화되었다. 그런데 자신이 잃은 전자로 Cl를 환원시켰다. 이 반응에서
Na를 환원제 (reducing reagent)라고 한다. Cl2는 Na에서 전자를 빼앗아 와서 환원
되었지만 거꾸로 Na를 산화시켰으므로 산화제, 산화력이 크다 또는 산화성이 있다라고 한다.
다. 산화제 / 환원제가 되는 경향
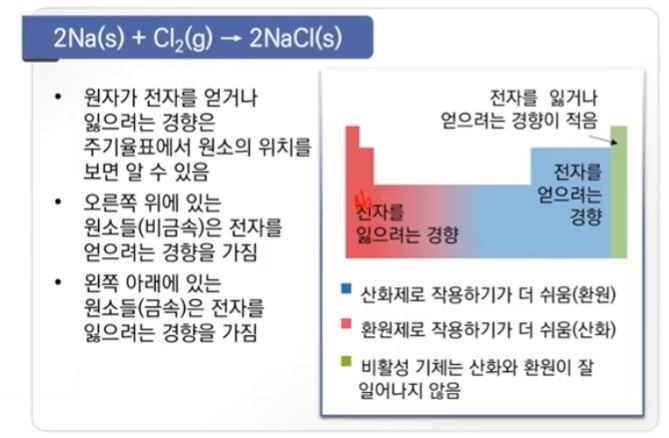
▣ 주기율 표에서 왼쪽 아래쪽에 있는 금속일 수록 전자를 잃기 쉬운 금속이고 오른쪽
위로 갈수록 전자를 얻으려는 경향이 강한 비금속 물질이다. 오른쪽 위로 갈수록
산화제 작용하기가 쉽고 왼쪽 아래로 갈수록 환원제로 작용하기가 더 쉽다.
예제1) 다음 반응에서 탄소는 환원되는가 ? 환원되는가 ?
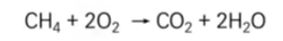
[풀이] 메테인(CH4)의 탄소는 수소를 잃고 산소와 결합하게 되므로 산화됨

2. 산화수
가. 산화 환원 반응과 산화수
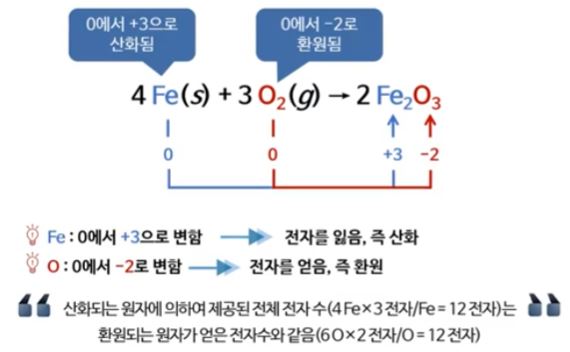
▣ 산화, 환원 반응을 숫자로 계산하려고 만들어 낸 개념이 산화수이다.
▣ 철은 철 원소만 있을 때는 전하량이 없으니까 "0"이다. 그런데 산소와 결합했다면 산소는
전자 2개를 빼앗는 것이 기본인데 산소가 3개 이니까 전자 6개가 부족하다. 따라서
철 하나당 전자 3개를 담당하여 전체적으로 "0"이 되어 화합물이 되는 것이다.
철은 0에서 +3이 되었으니 전자를 잃어 산화된 것이고 산소는 0에서 2-가 되었으니
전자를 얻어 환원된 것이다.
나. 산화수의 정의
▣ 산화수 (Oxidation Number, 또는 산화 상태)
⊙ 공유결합에서 모든 전자가 전기음성도가 큰 원자에 속한다는 가정하에 원자에 임의로 할당된 전하
▣ 반응 전후에 한 원자의 산화수를 비교하면 원자들이 전자를 얻었는지 또는 잃었는지를 알 수 있음
▣ 반드시 이온 전하를 의미하지는 않는다는 것에 유의해야 함
▣ 산화 - 환원 반응에서 전자의 추적에 도움을 주는 단순하고 편리한 방법임
▣ 물의 경우에는 H2O는 H2와 O가 공유결합을 한다. 이 때 전자를 산소쪽으로 살짝 당겨
지긴 하지만 그렇다고 수소가 완전히 전자를 잃어 버린 것은 아니다. 공유결합은 이온
결합 처럼 전하수가 주고 받는 것이 명확하지 않으므로 이럴 때는 전자를 얻는 것인지
잃는 것인지 모호할 수 있다. 따라서 공유결합한 두원자 중에서 전기음성도가 큰 원자
가 전자를 가져갔다고 본다. 그래서 산소가 최외각 껍질 전자가 6개가 있었는데 수소의
전자 21개를 가져가 산소는 전자가 8개가 된다. 산화수는 원래의 원자 최외각 전자수
빼기, 공유 전자를 전기음성도가 센 원자가 전자를 가져간다고 가정했을 때, 이 전자수
를 빼서 계산하면 6 - 8 = -2 가 된다. 수소는 최외각 전자가 1개 있는데 이것을 빼앗겼
으니까 전자가 없는 것과 마찬가지가 되었다. 그래서 수소는 1 - 0 = +1 이 된다.
이것이 산화수 개념이다.
다. 산화수 규칙
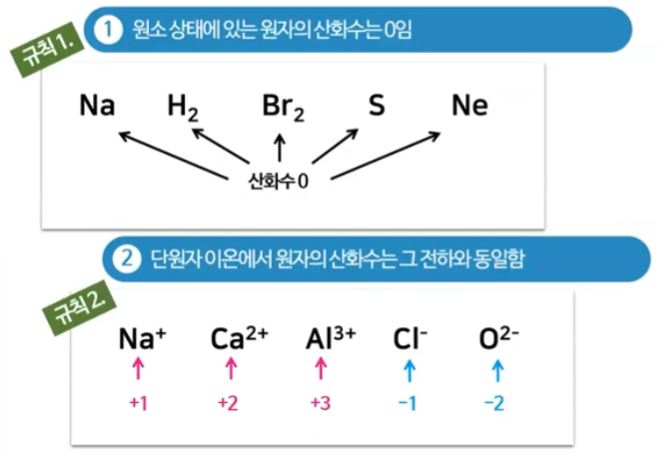
▣ 홑 원소 물질로 된 원소상태에 있는 물질들은 산화수가 모두 "0"이다. 이 물질은 다른
물질과 결합한 것이 아니므로 전자를 빼앗기거나 가져오지 않은 상태이다. 그런데 이
물질, 원자하나가 이온화를 하면 단원자 이온에서 원자의 산화수는 그 이온이 가지는
전하수와 같다. 원자 하나가 이온이 되었을 때 산화수는 그 물질의 전하수이다.
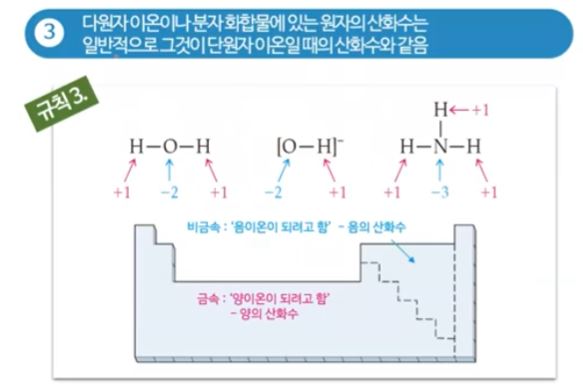
▣ 다원자 이온일 때는 물(H2O)을 예로 들면, 다원자 이온이나 분자화합물이 있을 때는
물은 산소가 전자를 세게 당기므로 산소는 특별하지 않은 경우 산화수는 -2이다. 대부분
의 산소는 최외각 껍질 전자가 6개로 전자 2개를 가져 오므로 산소는 -2, 수소는 +1이 된다.
▣ 그런데 O-H 라는 수산화이온은 왜 생겼을까 ? 산소가 -2 이고, 수소가 +1이기 때문에
암모니아는 수소보다 질소가 전자를 당기는 힘이 세서 수소가 +1, 질소가 -3이 된다.

▣ 수소는 최외각 껍질 전자수가 1개인데 첫번째 껍질은 전자가 최대 들어가 봐야 2개가
들어 가므로 여기에 전자가 하나 있다는 것은 반만 채워진 개념이다. 수소는 주기율표에
서 자신보다 왼쪽에 있는 금속과 만나면 이들 금속보다 전자를 세게 당기니까 수소가
마이너스(-)로 작용하고 오른쪽에 있는 비금속을 만나면 전자를 세게 당기지 못하므로
전자를 잃어 플러스 (+)로 작용한다. 따라서 수소의 산화수는 +1 이거나 -1이다.
그런데 수소가 탄소와 결합할 때에는 비극성, 무극성 공유 결합이 된다. 이들간에는
전자의 쏠림현상이 없다.
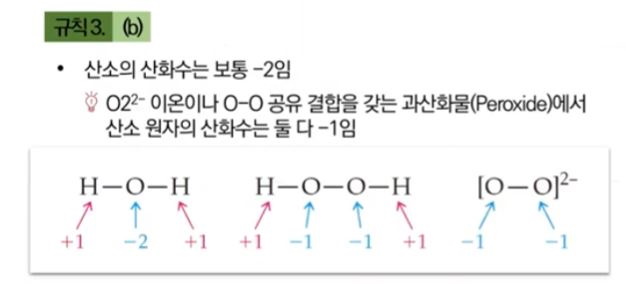
▣ 산소는 일반적으로 산화수가 -2이다. 그런데 그렇지 않은 경우가 있다. OF2 라는 분자이다.
불소 (F)는 전기음성도에서 범접 불가이다. 전기형성도가 무조건 제일 세다.
불소(F)는 어느 물질에서든 전자를 항상 빼앗아 오는 물질이다. 그리고 최외각 전자가
7개라서 항상 산화수는 -1이다. 그런데 불소(F) 2개가 있으니 산소는 +2가 된다.
산소는 일반적으로 전자를 빼앗는 -2의 역할을 하지만 불소를 만나면 전자를 빼앗기는
+2 의 역할로 변한다.
▣ H2O2는 산소보다 전자를 못 빼앗으므로 오히려 산소보다 전기 음성도가 작으니까 수소
+1 이 2개 있고 원래 산소는 -2가 되어야 하는데 수소가 줄 수 있는 전자가 없어서 -1개
짜리 2개인 과산화, 불안정한 물질이 된다.

▣ 할로젠, F, Cl, Br, I 는 일반적으로 산화수 -1을 갖는다. 17족 원소이니까 최외각 전자수가 7개 있다.
그런데 Cl2O라는 분자로 있을 때는 F, Cl, Br, I 계열 원소중 F는 산소보다 전기 음성도가 크지만
Cl, Br, I 는 산소(O)보다 전기음성도가 크지 않다. 따라서 Cl2O 에서 O는 -2이고
Cl 원자 하나가 +1을 가질 수 밖에 없다. F를 제외한 Cl, Br, I 는 산소 (O)와 만나면 상황이 달라진다.

▣ 중성인 분자에서는 산화수 합이 분자가 되고 H2SO4에서 분자면 "0"이 되고 산화수의
합이 "0"이 되어야 한다. 따라서 합이 "0"이 되려면 S는 +6이 된다.
▣ 다원자 이온에서는 산화수 합이 알짜 전하수와 같다.
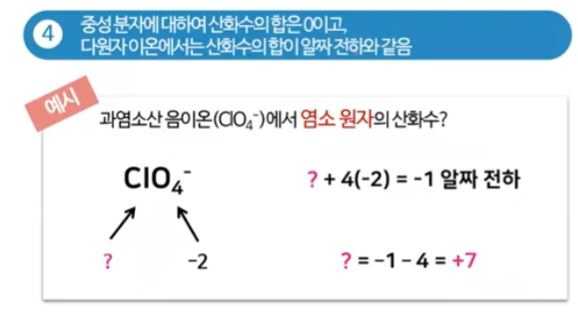
▣ ClO4-, 과염소산 이온인데 여기에서 산소는 일반적인 경우로 산화수가 -2이고 산화수의
합이 -1이 된다는 것이다. 그러면 Cl은 +7이 되어야 한다.
라. 산화, 환원 반응 요약

▣ 산화는 전자를 잃고 전자를 잃으면서 산화수가 증가되면서 잃은 전자를 다른 물질에게
주었으므로 환원제가 된다.
3. 산화 환원 반응의 종류
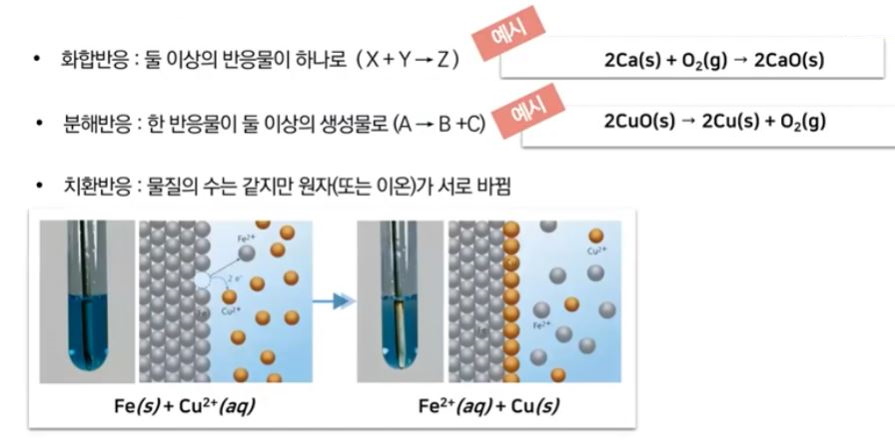
▣ 산화반응은 여러가지가 있지만 2 이상의 반응물이 하나로 되는 화합반응이 있다. 칼슘과
산소가 만나서 산화칼슘, 석회가 되는 과정도 칼슘이 산소에게 전자를 빼앗기고 CaO가
되는 반응이다.
▣ 분해반응은 하나의 반응물이 2 이상의 생성물로 쪼개지는 반응이다. 산화구리가 가열 등을 통해서
구리와 산소로 분해되는 과정이 그 예이다.
▣ 치환반응이 제일 중요하다. 위 그림에서 파란색 용액이 황산구리 용액이다. 이 용액에
쇠 못을 넣는다. 황산구리 용액은 황산 2-, 구리 2+이다. 철이 구리 보다 이온화 경향이 크다.
이온화 경향에 따라 구리가 전자를 버리고 이온화하여 있는데 철이 구리한테 전자 를 주고
철이 녹아 들어가서 철이 구리와 치환되게 된다. 철과 구리가 원자로 있던 물질이 이온화되고
이온으로 있던 물질이 원자로 있게 된다.
▣ 연소반응도 빛과 열을 내면서 산소와 결합하여 격렬하게 타는 것이므로 산화반응이 된다.
가. 산화 · 환원 반응의 이용 : 녹슨 철과 용광로

▣ 산화반응을 이용하는 것은 녹슨 철을 용광로에 넣은 예를 들어 보자. 철광석(고철)과
코크스를 용광로에 넣으면 코크스는 산소와 결합하여 일산화탄소(CO)가 된다. 이 때
철광석 (고철, 산화철)에 있는 산소를 떼어 온다. 철광석은 산소를 잃었으니까 환원이
된다. 일산화탄소는 이산화탄소(CO2)로 산소의 개수가 많아졌으므로 산화된 것이다.
이런 과정을 통해 녹슨 철을 다시 사용할 수 있는 철로 재생산하는 것이다.
나. 산화·환원반응의 부작용

▣ 산화·환원 반응의 부작용도 있다. 철이 산소, 물을 만나면 녹이 슬어 버린다. 그런데
녹슨 철의 가장 큰 문제점은 이는 금속이 퇴화되는 과정이다. 철, 쇳덩어리는 녹슬어 버
리면 손톱으로도 긁히게 된다. 이것이 산화·환원 반응에서 나올 수 있는 부작용이다.

▣ 알루미늄은 산소와 결합하여 표면을 Al2O3, 산화알루미늄이 되고 알루미늄 자체만은
녹는 점이 약 1000[℃] 정도 인데 산화알루미늄은 녹는 점이 2860[℃] 정도가 된다.
거의 산화알루미늄이 생기면서 보호막을 역할을 하게 되어 알루미늄이 부식되는 것을
방지하는 효과를 나타내게 된다.
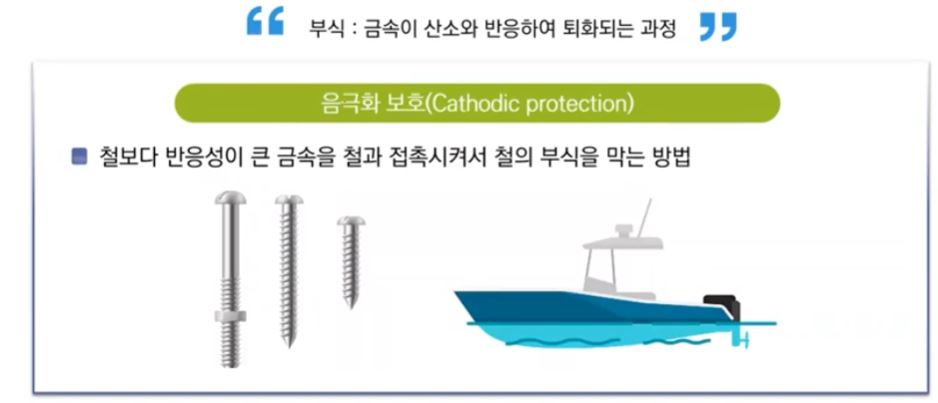
▣ 음극화 보호 (Cathodic protection)라는 것은 선박의 경우 바닷물과 접촉을 한다. 바닷물은
이온이 가득찬 물인데 이와 접촉하면 부식이 잘 된다. 배는 쇠로 만드는데 쇠가 바 닷물과 접촉하면
쉽게 부식할 수 있다. 페인트칠 할 수도 있지만 그러면 벗겨질 수도 있다.
이런 경우 부식을 방지하기 위해서 아연 조각을 붙여 놓는다. 아연이나 마그네슘을
붙여 놓을 수 있는데 주로 아연을 붙여 놓는다. 아연은 철 보다 먼저 부식이 되면서 산화가 되면서
전자를 내 놓는다. 내 놓은 전자를 계속하여 철에 공급을 하여 철이 전자를 잃고 산화되어야 하는데
계속 전자를 공급해 주므로 철이 산화되는 것을 막아 주는, 철의 부식을 방지하는 역할을 하게 된다.
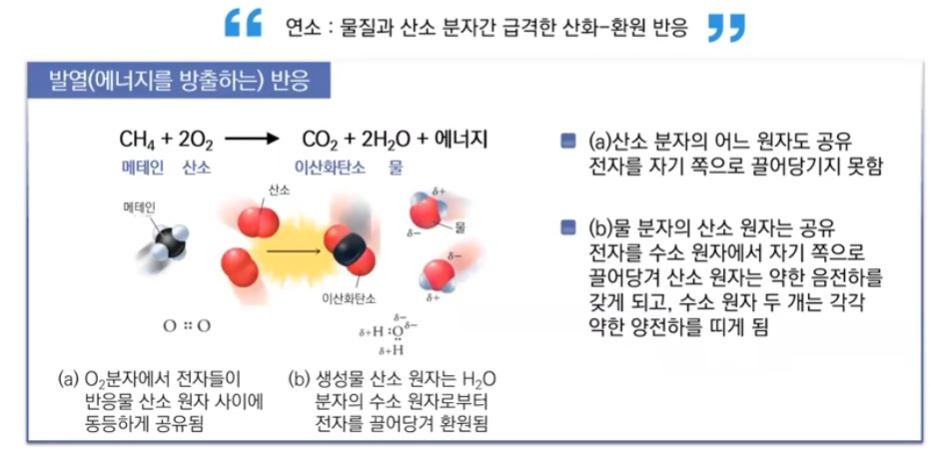
▣ 연소는 물질이 산소분자간에 급격한 산화·환원 반응을 하는 것이다. 연소는 발열, 에너지를
방출하는 반응이다. 메테인과 산소가 만나게 하면 탄소도 이산화탄소가 되고 산소도 수소를 만나
물 또는 수증기가 된다. 이런 반응이 일어나는 이유는 원래 산소는 산소원자 로 있을 때는
같은 산소원자끼리 있으므로 다른 원자의 전자를 끌어 당기지 못한다. 그런 데 이산화탄소를 만나도
산소가 전기음성도가 크니까 전자를 당기고 수소를 만나도 산 소가 전기음성도가 크니까 전자를 당기고
산소가 전자를 당기는 힘 자체가 편안해지게 된다. 산소는 전자를 보면 끌어 당기고 싶어서 난리인데
이산화탄소와 결합하거나 수소와 결합하면서 산소가 전자를 당겨 오기가 쉬워지는 것이다.
따라서 이런 반응은 폭발적으로 일어나기가 쉽다.
4. 산화 · 환원반응의 완결
가. 반쪽 반응법 (Half reaction method)을 이용한 산화·환원 반응 완결

▣ 화학식을 완결하기 위해서 추가할 수 있는 화학종 2개
① 반응이 수용액에서 일어 날 경우 화학반응식의 균형을 맞추기 위해 물(H2O)을 추가할 수 있다.
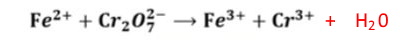
② 산성 용액에서 반응이 일어나는 경우 반응식의 균형을 맞추기 위해 수소이온(H+)을추가할 수 있다.
(염기성 용액의 경우 수산화 이온(OH-)을 추가할 수 있다.
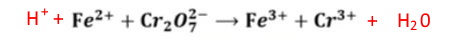
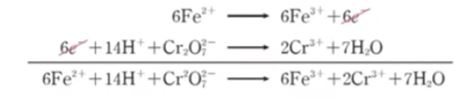
▣ 위 화학반응식에서 철은 산화수가 +2이다. 그런데 반응을 하여 3+가 됐다. 전자하나를
잃은 것이 된다. 산소는 특별한 경우 (불소(F)와 결합하거나 수소와 결합하는 경우
H2O2 같은 과산화물이 되는 경우)가 아니면 산소는 산화수가 -2인데 이런 산소가 7개
있다. 그런데 전체적으로 산화수가 2- 라고 한다. 그러면 Cr 2개는 +12가 되어야 하고
이는 결국 Cr하나는 +6라는 것이 된다. +6짜리 Cr이 +3이 되었으니 Cr은 환원반응이
된다. 이렇게 반응식을 맞추어 간다. 이 반응에서 Cr이 +6짜리가 +3짜리 Cr이 되면서
환원되고 철은 산화된다는 것을 알 수 있다. 산화·환원 반응은 수용액에서 일어난다고
가정한다. 따라서 반응의 균형을 맞추기 위해 물을 추가할 수 있다. 왜냐면 반응물에
산소가 있는데 생성물에는 산소가 없기 때문이다. 따라서 균형을 맞추기 위해 물을
추가하는 것이다. 그런데 물은 O2-와 H+ 두 개가 만난 것으로 생각하여 산소의 균형을
맞추기 위해 H2O가 들어 갔더니 반응물 쪽에 H가 필요하게 된다.
▣ 이제 반응식의 균형을 맞추기 위해 H+를 반응물 쪽에 추가할 수 있다.
생성물에 물(H2O)가 들어 갔으므로 H+를 넣을 수 있고 만약에 염기성 용액에서 균형을
맞출 경우 OH-를 추가할 수도 있다.
[완결방법 정리]
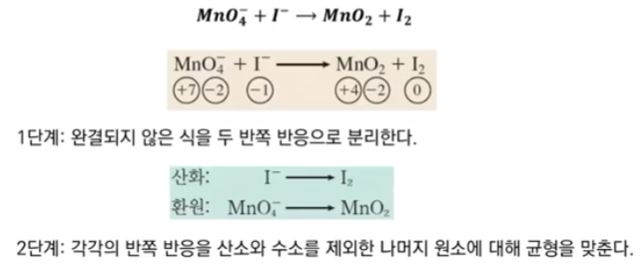
1. 반응을 산화 반쪽 반응과 환원 반쪽반응으로 나눈다.

2. 반쪽 반응을 산소와 수소를 제외한 나머지 원소들에 대해 균형을 맞춤
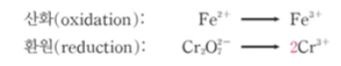
3. 양쪽 반응식에 물(H2O) 를 추가하여 산소에 대한 균형을 맞춘다. 각 물질의 산화상태는 변화가 없다.
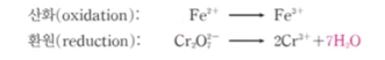
4. 양쪽 반쪽 반응식에 수소 이온 (H+)을 추가하여 수소에 대한 균형을 맞춘다.
각 물질의산화상태는 변화가 없다.
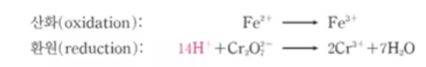
5. 양쪽 반쪽 반응식에 전자를 더해 전하 균형을 맞춘다. 전자를 더해 양쪽의 전체 전하가 같도록 해 준다.
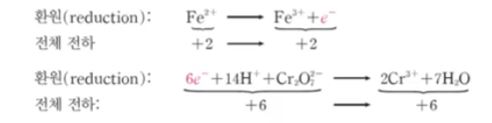
6. 만약 산화 반쪽 반응의 전자수와 환원 반쪽 반응의 수가 서로 일치하지 않는 경우,
양쪽의 전자수가 동일해지도록 한쪽 또는 양쪽 반쪽 반응에 정수를 곱해 준다.

7. 마지막으로 균형된 반쪽 반응식을 더한 뒤 양쪽의 전자를 소거하고 나머지 요소들을 표시한다.
<염기성 수용액의 경우>
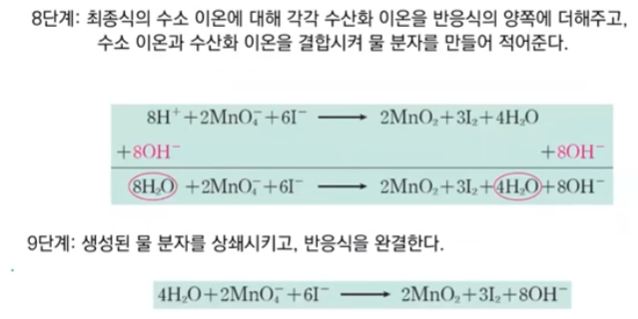
8. 마지막으로 얻어진 균형식의 수소이온 (H+)마다 양쪽에 수산화 이온 (OH-)을 더해 주고
두 이온이 결합하여 물(H2O)을 생성하도록 한다.
9. 새롭게 생긴 물 분자로 인해 상쇄되어야 하는 항을 상쇄하여 식을 완성한다.
예제) 과망가니즈(Permanganate) 이온과 아이오딘(Iodide)이온은 염기성 용액에서 반응하여
이산화 망가니즈[manganese (Ⅳ) Oxide] 와 아이오딘 분자 (molecular iodine)를 생성한다.
반쪽 반응법을 이용하여 반응식을 완결하여라.
[풀이]


[염기성 용액이므로]
'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 전기분해와 전해전지 - 기초 화학 (4) | 2022.12.19 |
|---|---|
| 전기화학과 화학전지 - 기초 화학 (2) | 2022.12.16 |
| 엔트로피와 자유에너지 - 기초 화학 (0) | 2022.12.13 |
| 산과 염기의 평형 - 기초 화학 (0) | 2022.12.11 |
| 산과 염기 - 기초 화학 (2) | 2022.12.08 |
