【 목 차 】
1. 분자의 루이스 구조
2. 전자쌍 반발 이론
3. 결합각과 분자의 구조
4. 극성분자와 무극성 분자
5. 분자간 힘
1. 분자의 루이스 구조
단계 1. 분자에 있는 전체 원자가 전자의 수를 구한다.
단계 2. 원자 사이를 단일 결합으로 연결한다.
(중심원자는 수소를 제외하고 전기음성도가 제일 낮은 원자로 정하고 2주기 원소들을
팔전자 규칙을 만족하도록 결합수를 정한다. 붕소(B)는 예외적으로 전자 결핍이 되고,
3주기 이상의 원소들은 d오비탈의 영향으로 확장된 팔전자 규칙을 따르기도 한다)
단계 3. 단계1 에서 구한 전체 원자가 전자 수로 부터 결합에 이용한 원자가 전자수를 뺀
나머지 전자들을 전기 음성도가 큰 말단 원자에 할당하여 팔전자 규칙을 정한다.
단계 4. 단계 3 이후에도 할당되지 않고 남은 전자가 있다면 중심 원자에 배치한다. (중심
원자가 3주기 이상이면 전자를 8개 보다 많이 가질 수 있다!!!)
단계 5. 만약 중심원자가 팔전자 규칙을 만족하지 못한다면 다중결합을 만든다.
▣ 14족 C - 4, 15족 N - 3, 16족 O - 2, 17족 F - 1 이 있다면 이 때 중심원자를 전기
음성도가 제일 낮은 우너자로 정한다는 것은 위 원소중에서는 탄소(C)가 전기음성도가
제일 낮으니까 결합을 제일 많이 할 수 있는 원소를 가운데 넣는다.
▣ 팔전자 규칙을 따르는데 예외로 붕소(B)는 최외각 전자껍질의 전자수가 3개 인데 최외
각 전자가 6개만 있어도 안정을 취하는 특이한 원소이다.
예 ) SF4
SF4 ⇒ S : 6개 F4 : 7 × 4 =28, ∴ 6 + 28 = 34 (최외각 전자 합계)
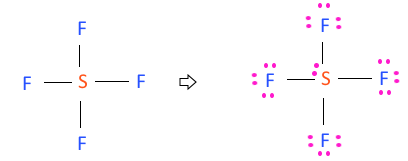
⊙ 결합선 하나에 2개씩 결합하니까 2 × 4 = 8
따라서 34 - 8 = 26개가 최외각 전자가 남는다.
점전자 구조에 따라 팔전자 규칙을 따라야 하므로
26 - 6 × 4 = 2 그래도 전자 2개가 남는다.
이 남는 전자 2개는 중심원자에 배치한다.
※ 중심원자가 3주기 미만이어서 중심원자에 전자를 배치하지 못하는 경우의 예를 들어 보자.
이런 화합물에는 HCN, CO2, CH4O, C2H4, C2H2가 있는데
◈ 먼저 C2H4 의 루이스 분자 구조를 알아 보자.
C2H4 : 원자가 전자수는 H -1×4, C - 4×2, 1×4+4×2 = 12개 이다.
탄소는 결합수 4개, 수소는 1개 이므로 탄소(C)를 중심에 놓는다.

원자간 단일결합을 한다. 단일 결합이 5개 이므로 5×2= 10, 전자 10개를 사용했으므로
12 - 10 = 2, 전자 2개가 남는다. 남은 전자 2개를 중심원자에 두어야 하는데 한쪽 탄소
원자에 2개를 두면 다른 쪽 탄소 원자는 팔전자 규칙을 충족할 수 없고 탄소의 결합수를
맞출 수 없게 된다. 따라서 탄소(C)와 탄소(C)는 이중결합을 하게 된다.
◈ HCN의 분자구조에 대하여 알아 보자.
HCN : 원자가 전자수는 H - 1×1, C - 4×1, N - 5×1, 합하면 1+4+5 = 10개이다.
수소는 결합수 1개, 탄소는 4개, 질소는 3개 이므로 결합수가 많은 탄소(C)를 중심에 놓는다.
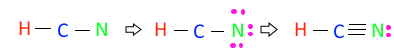
이 3 원소를 단일결합을 시키자. 단일결합이 2개 이므로 2×2=4, 4개의 전자를 사용했으
므로 10-4=6, 6개 전자가 남았다. 남은 6개 전자는 전기음성도가 가장 큰 원소를 주라고
했고 전기음성도는 F-O-N 순이므로 질소(N)에 전자를 배치한다.
질소(N)에 전자를 배치하고 보니 탄소(C)는 결합수가 4개이어야 하는데 2개 밖에 없으
므로 질소(N)의 최외각 전자 4개를 이용하여 탄소(C)와 질소(N)간에 공유결합을 한다.
이렇게 공유 결합을 하면 탄소(C)와 질소(N)간에 3중 결합을 하게 되고 탄소(C)와 질소
(N) 모두 팔전자 규칙을 만족 시키게 된다.
◈ CO2의 분자구조에 대하여 알아 보자.
CO2 : 원자가 전자수는 C - 1×4, O - 6×2, 합하면 4+12 = 16개이다.
전자결합수는 C - 4, O - 2 이므로 결합수가 많은 탄소(C)를 중심에 둔다.
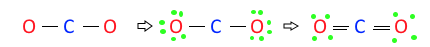
결합수가 2개 이므로 2×2=4, 전자 4개를 사용했으므로 16-4=12개가 남았다.
전기음성도가 높은 산소(O)에 남은 전자 12를 산소(O)에 배치하여 팔전자 규칙을 만족하
자. 그런데 이렇게 하면 탄소(C)는 팔전자 규칙을 만족하지 못하여 2개의 산소(O)의 전자
2개씩 4개를 이용하여 탄소(C)와 산소(O)간 공유결합을 하면 탄소(C)와 산소(O)는 이중
결합이 되고 둘 다 팔전자 규칙을 만족하고 탄소(C)의 결합수도 맞출 수 있다.
◈ CH4O의 분자구조에 대하여 알아 보자.
CH4O : 원자가 전자수는 C-4×1, H-1×4, O - 6×1, 합하면 4+4+6 = 14개이다.
전자결합수는 C - 4, H - 1, O -2 이므로 결합수가 많은 탄소(C)를 중심에 둔다.

단일 결합이 5개이므로 전자 5×2=10개를 사용했으므로 14-10은 4개 남았다.
산소의 전기음성도가 가장 크므로 남은 전자 4개를 산소(O)원자에 배치한다.
이렇게 하면 탄소(C), 수소(H), 산소(C) 모두 결합규칙을 만족하게 된다.
◈ C2H2의 분자구조에 대하여 알아 보자.
C2H2 : 원자가 전자수는 C-4×2, H-1×2, 합하면 8+2 = 10개이다.
전자결합수는 C - 4, H - 1 이므로 결합수가 많은 탄소(C)를 중심에 둔다.

단일 결합수가 3개이므로 3×2=6, 6개의 전자를 사용하였으므로 10-6=4, 4개의
전자가 남는다. 남은 4개 전자를 전기음성도가 큰 탄소(C) 원소에 각각 2개씩을
배치하면 탄소의 팔전자 규칙을 만족한다. 그런데 탄소의 결합수는 4개이므로
부족한 4개를 탄소(C) 원자의 최외각 전자 2개씩을 활용하여 탄소(C)-탄소(C)의
공유결합을 하면 3중 결합을 하게 된다.
가. Review : 전자구름 배열 및 분자 모형을 결정하는 단계
① 분자 또는 다원자 이온의 Lewis 구조를 그린다.
② 중심원자의 전자구름수를 센다.
③ VSEPR 모델을 적용하여 전자구름의 기하구조를 결정한다.
④ 원자핵 사이를 연결하여 분자의 모양을 결정한다.
[루이스 분자 구조와 분자의 모양과 어떤 관계가 있는지 알아 봅시다]
가. CH2O
◈ CH2O의 분자모양에 대하여 알아 보자.
CH2O : 원자가 전자수는 C-4×1, H-1×2, O-6×1 합하면 4+2+6 = 12개이다.
전자결합수는 C - 4, H - 1, O-2 이므로 결합수가 많은 탄소(C)를 중심에 둔다.
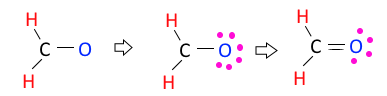
단일 결합이 3개 이므로 3×2=6, 6개 전자를 사용했으므로 12-6=6, 6개의 전자가 남고
남은 전자 6개를 전기음성도가 높은 산소(O)에 배치한다. 그런데 탄소의 결합수 4개를
맞추기 위해 산소의 최외각 전자 2개를 탄소(C)와 공유결합을 하게 되면 탄소(C)와 산소
(O)는 2중 결합을 하게 된다.
여기에서 중심원자 탄소(C)를 중심으로 전자구름을 보면 중심원자 탄소 주위에 이렇게
이중결합- 뚱뚱한 전자결합이 하나 있고 단일결합 - 가느다란 전자구름이 2개가 있다.
결국 탄소 주위에는 3개의 전자구름이 있다. 이들 전자 구름간에는 반발력이 있게 된다.
이 전자구름간에는 반발력이 작용하여 가장 멀리 있으려고 하고 가장 멀리 있으려면
평면 삼각형 모양이 되고 아래 그림과 같이 있게 된다.

전자구름의 기하구조를 결정하려고 하는데 이들간에는 서로 멀리 있으려 하니까 평면
삼각형 모양이 되고 이 때 이 분자의 모양은 언제나 전자구름을 이렇게 배열해 놓고
분자의 모양은 원자의 핵과 핵 사이를 결합하는 것이 분자 모양이다.
따라서 CH2O의 분자모양은 평면 삼각형 모양이 된다.
예제) 다음 각 화합물 들에 대해 전자구름의 기하 구조와 분자모양을 정하시오.
[ SO3 와 ICl4- ]
▣ SO3
SO3 의 원자가 전자수는 S- 6, O3 - 6×3 합하여 6 + 18 = 24 이다.
황(S)보다 산소(O)가 전기음성도가 크므로 S보다 O가 위에 있게 되므로 S를 중심에 둔다.
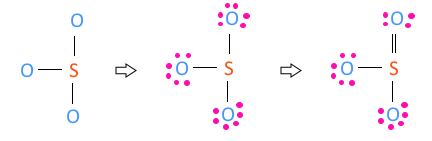
단일 결합이 3개 이므로 3 × 2 =6, 6개 전자를 사용하였으므로 24 - 6 = 18, 18개의 전
자가 남는다. 남은 전자 24개를 전기음성도가 높은 높은 산소(O) 원자 3개에 배치한다.
그런데 이렇게 되면 황(S)은 최외각 전자가 6개 밖에 되지 않는다. 이를 해결하기 위하여
산소(O) 원자 3개 중 하나의 원자의 최외각 전자 2개를 이용하여 황(S)와 산소(O)간의
공유결합을 하는데 사용한다. 따라서 황(S)와 산소(O)간에 이중결합 하나가 생긴다.
이런 구조상에서 분자의 모양을 결정하라 하면 분자 모양은 전자의 구름형태를 본다고
했다. 중심원자의 황(S)를 중심으로 보면 전자구름은 3개가 된다. 전자구름 간에 반발력
이 있어 서로 멀리 떨어져 있으려고 하니까 평면 삼각형 모양이 된다.
즉, 분자모양은 원자 핵과 핵 사이의 평면 삼각형이 된다.
▣ ICl4-
ICl4- 의 원자가 전자수는 I 아이오딘에 Cl 이 4개 있고 마이너스(-) 이온이다.
이런 경우 아이오린이 마이너스(-), 아이오딘은 제일 바깥 껍질의 전자가 7개이다. Cl은
원래 제일 바깥 껍질의 전자가 7개인 원소가 4개 있다. 그런데 이것이 마이너스(-) 이온화
되었다고 하니까 전자가 하나 더 있는 것이다.
그러므로 원자가 전자수는 C-7, Cl4 - 7×4+1 합하여 7+29 = 36개가 된다.
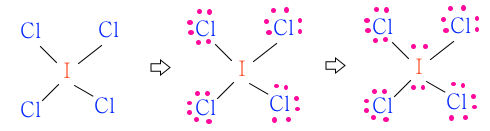
여기에서 I 와 Cl 을 비교해 보면 전기 음성도가 F - Cl - Br - I 순이므로 Cl이 I 보다 전기
음성도가 크다. 그러므로 I 가 중심원자가 되어야 한다.
남은 전자 28개를 전기 음성도가 높은 Cl에 배치를 하면 28-24=4개의 전자가 남게 된다.
그런데 남은 전자 4개는 마이너스(-) 이온에 의하여 들어 온 전자는 중심원자에 들어가야
한다. 왜냐하면 Cl은 7개가 단일 결합하는 방법 밖에 없기 때문이다.
I 와 Cl간 단일 결합을 하면 결합수가 4개 이므로 4×2=8, 8개의 전자를 사용했으므로
36-8=28개의 전자가 남게 된다.
남은 전자 28개를 전기음성도가 높은 염소(Cl) 원자 4개에 배분한다.
이제 남은 전자 4개를 중심원자 아이오딘(I) 에 배치한다. 아이오딘(I) 은 5주기 원자이므
로 중심원자에 전자를 배치할 수 있다. 3주기 이상의 원소에는 전자가 들어 갈 영역이 넓어
서 남은 전자를 중심 원자에 줄 수 있다.
전자 구름을 보면 평면 사각형 전자구름이 있고 또한 아이오딘(I) 위 아래에 전자구름이 있
는 모양이 된다. 아이오딘(I) 위 아래에 전자구름은 분자 모양을 나타낼 때는 나타나지 않는
다. 분자모양은 원자핵과 핵 사이의 관계를 나타내는 것이기 때문이다.
따라서 분자 모양은 평면 사각형 모양이 된다.

2. 전자쌍 반발이론 (Valence-shell electron-pair repulsion, VSEPR)
가. 분자의 기하구조
▣ 중심원자 주위의 전자구름들이 서로 반발하기 때문에 가능하면 멀리 떨어지게 배치
▣ 전자구름은 결합의 차수 (단일, 이중 또는 삼중결합)에 관계없이 모든 결합과 고립 전자쌍, 그리고 홀전자를 의미함)

나. 중심원자 주위의 전자구름 배열

▣ 분자의 모양은 위 그림과 같은 모양이다. 중심원자를 중심으로 주변에 결합이 2개 있으
면 직선형 모양이 되고 3개면 삼각평면형, 4개면 정사면체, 5개면 3개는 평면 삼각형을
이루고 2개는 위·아래 쪽으로 삼각뿔 형태를 이룬다. 삼각쌍뿔의 경우에는 평면삼각형
의 경우 내각이 120°를 이루는데 위·아래 삼각뿔은 평면과 90°의 각도를 이룬다.
따라서 평면은 넓게 퍼져 있어 반발력이 적게 작용한다. 이렇게 전자구름의 반발력이 차
이가 있어 결합각이 큰 곳에 비공유 전자쌍이 있기 좋고 더 좋은 것은 위·아래 각도가
90° 에 들어가도 좋다. 이것이 바로 '전자쌍 반발이론'이다.
다. 전자구름 배치 vs 분자 모양
▣ 중심 원자 주위의 전자구름 (결합과 고립 전자쌍 또는 홀전자)의 배열인 전자구름 기하
구조와 결합된 원자의 배열인 분자의 모양은 다르다 !!!)
▣ 분자 모양의 결정법
① 분자의 루이스 구조를 그린다.
② 중심원자 주위의 전자구름을 VSEPR 이론에 맞춰 배치한다.
③ 분자를 구성하는 원자의 핵들을 연결하여 분자모양을 결정한다.
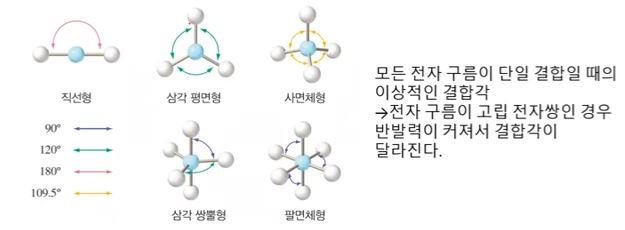
※ 전자 구름이 고립 전자쌍인 경우에는 결합각이 작아져서 반발력이 커질 수 있다.

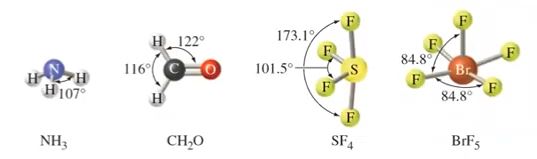
CH4 의 경우에는 전자구름 4개가 모두 단일 결합으로 정사면체로 결합각이 모두 109.5°
로 동일하다. NH3는 삼각뿔 형태로 위에 비공유 전자쌍이 있어 가느다란 전자쌍이 비공유
전자들을 끌어 당겨 결합각이 109.5°에서 107°로 줄어든다.
H2O는 넓게 펼쳐진 비공유 전자쌍이 2개가 있다. 비공유 전자쌍은 공유전자쌍에 끌어 당
겨져서 결합각이 104.5°로 줄어든다.
분자의 모양이 굽은 모양이 되는 이유는 분자의 모양은 핵과 핵 사이를 연결하는 선이다.
비공유 전자쌍이 있는 곳은 전자 구름이 있어서 이 공간에는 다른 전자가 들어 오지 못하게
하는 공간의 영역을 나타내지만 실제 분자의 모양은 핵과 핵 사이를 연결한 선이 분자의
모양이기 때문에 연결선 2개가 만들어지는 굽은 모양의 평면이 존재하게 되는 것이다.
3. 결합각과 분자 구조
가. 5개의 전자구름 : PCl5, SF4, ClF3, I3-
◈ PCl5
인(P)은 최외각 전자가 5개, 염소(Cl)는 최외각 전자가 7개인데 원자가 5개 이므로
전체 최외각 전자수는 5 + 7 × 5 = 40 개가 된다.
결합수가 많은 P를 중심에 둔다.
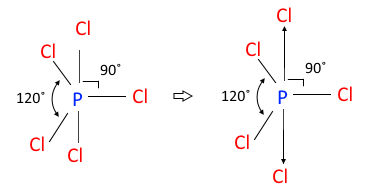
▣ 5개의 전자구름은 평면 삼각형 위·아래에 전자구름이 있는 형태이다. 이런 분자구조를
'삼각쌍뿔'이라고 한다.
▣ 결합각 90°가 120° 보다 반발력이 더 세게 작용하므로 결합각 90°에 있는 염소(Cl)이
더 멀어져서 "정몇몇면체"가 아니고 삼각쌍뿔이라고 한다.
◈ SF4
S는 최외각 전자가 6개이고 F는 4개 이므로 결합수 4개를 하면 S의 비공유 전자 2개가
남는다. 따라서 비공유 전자쌍이 1개가 남게 된다.
전자쌍 중 가느다란 공유전자쌍 보다 뚱뚱한 비공유 전자쌍이 반발력이 크다.

비공유 전자쌍이 큰 반발력으로 공유 전자쌍을 옆으로 밀어서 치우친 전자쌍이 된다.
이런 모양을 '시소형'이라고 한다.
◈ ClF3
최외각 전자가 Cl은 7개이고 F가 3개가 결합하니까 단일결합은 3개이고 Cl의 비공유
전자쌍은 2개가 된다.

평면 삼각형에 있는 비공유 전자쌍 2개가 공유 결합 전자 구름을 밀게 된다. 분자 모양은
원자 핵과 핵 사이를 연결하는 것이므로 공유 전자쌍 연결선이므로 굽은 T자형이다.
◈ I3-
I는 최외각 전자가 7개인데 마이너스(-) 이온이므로 전자가 하나 더해져서 8개가 된다.
이것은 I- 와 I2 가 결합한 형태가 된다. 따라서 단일 결합 1개, 비공유 전자쌍이 3개 된다.
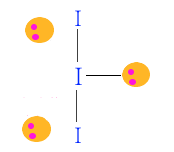
비공유 전자쌍이 평면 삼각형을 이루고 위·아래에 I가 놓이게 된다.
분자모양은 직선형이 된다.
나. 6개의 전자구름 : SF6, BrF6, XeF6
◈ SF6
황(S)은 최외각 전자가 6개이며 F6과 결합을 하므로 단일결합은 6개이고 비공유 전자쌍은 없게 된다.

이 분자 모양은 평면 4각형에 위·아래에 수소(H) 단일결합이 있고 모두 결합각이 90°가
된다. 분자 모양은 정팔면체가 된다.
◈ BrF6
Br은 최외각 전자가 7개이며 F5 와 결합을 하니까 단일결합이 5개, 비공유 전자쌍이 1개가 있다.

비공유 전자쌍은 위·아래 어디에 두어도 되는데 아래에 표기하는 것이 편하여 아래에 둔다.
이 분자 구조는 사각뿔이라고 하는데 비공유 전자쌍이 평면 사각형 공유전자쌍 구름을
위로 밀어 올리게 된다.
◈ XeF4
Xe는 제논이라고 해서 비활성 기체이다.
비활성 기체 (He, Ne, Ar, Kr, Xe, Rn) 중에서 He, Ne, Ar은 안정된 기체로 반응을 하지
않지만 Kr은 전자껍질이 4개, Xe은 전자껍질 5개, Rn은 전자껍질 6개이어서 플로우린
처럼 반응성이 큰 물질과는 반응을 하게 된다.
제논(Xe)은 최외각 전자가 8개이고 F4와 결합을 하므로 단일 결합이 4개, 비공유 전자쌍
이 2개가 된다.

분자 모양은 평면 사각형이고 위·아래에 비공유 전자구름이 있게 된다.
다. 분자유형과 기하구조의 관계
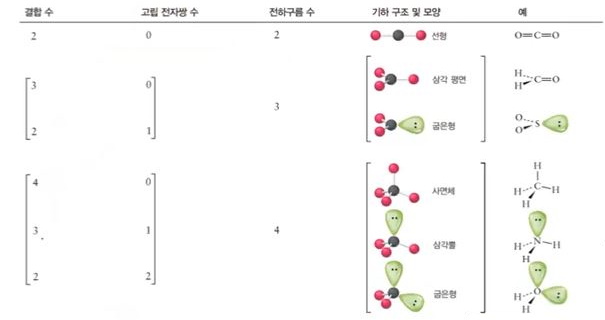

라. 이상적인 결합각과 편차
▣ 특정 전자구름은 다른 전자 구름 보다 이웃전자들과 더 잘 반발하기 때문에 이상적인
결합각에서 벗어날 수 있음
▣ 고립 전자쌍은 결합전자쌍 보다 더 많은 공간(space)을 차지하여 반발력이 더 큼
▣ 다중 결합은 더 높은 전자밀도를 갖기 때문에 단일 결합 보다 반발력이 큼
4. 극성 분자와 무극성 분자
가. 분자의 기하구조와 극성
▣ 쌍극자 모멘트는 동일한 화학식을 갖지만 원자의 기하구조가 다른 분자(기하이성질체)
를 구별하는 기준이 될 수 있다.
예) 다이클로로 에틸렌 (C2H2Cl2)
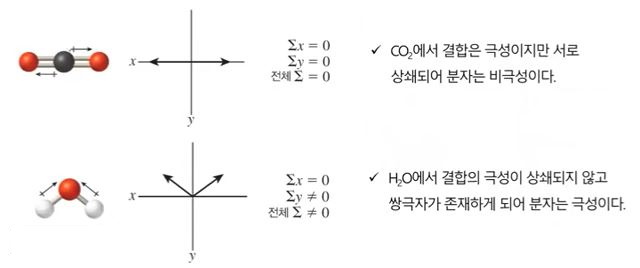
▣ 극성의 차이 때문에 이 두 이성질체는 쌍극자 모멘트를 측정함으로써 실험적으로 구별될 수 있음
5. 분자간 힘
가. 분자간 힘
▣ 분자량이 비슷한 분자들 사이에서만 비교 가능하다.
나. 무극성 분자 vs 극성 분자
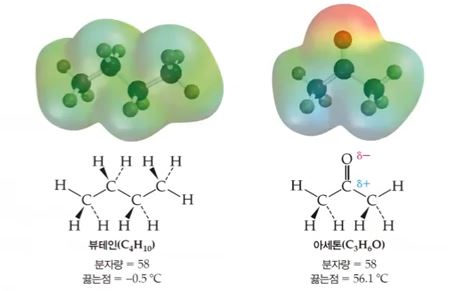
▣ 뷰테인과 아세톤은 분자량이 똑같은데 상온에서 아세톤은 액체, 부테인은 기체이다.
그 이유는 부테인의 C와 H는 무극성 결합이라서 전자가 골고루 퍼져 있다. 아세톤은
산소가 전자를 당기는 힘이 세서 극성결합이 된다. 극성 분자가 되면 옆에 있는 분자
들 간에 극성으로 인한 인력이 작용하여 분자의 결합이 강해진다. 분자결합이 강해지
므로 분자들간의 분해에 대한 저항력이 커져 끓는 점이 높아진다.
다. 수소결합
▣ 생화학적으로 필수적인 역할을 하는 거대한 생체 분자의 형태를 유지하는데 중요한 분자간 힘
★ 전기음성도가 매우 큰 원자 (O,N,F)에 결합한 수소원자와 똑같은 분자 또는 다른 분자
의 전자가 풍부한 영역간의 상호 인력
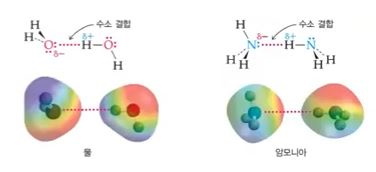
※ 수소결합은 분자간의 결합이지만 마치 플러스(+), 마이너스(-) 이온 결합과 같이
분자간의 결합이 매우 강하다.
▣ 수소가 전기음성도가 매우 큰 원소 (F,O,N) 들과 결합하면 전기음성도가 큰 F,O,N
원자가 수소의 전자를 당기므로 수소의 양성자 값이 +0.85에서 +0.9 정도가 된다.
이런 수소 옆에 비공유 전자쌍을 갖고 있는 F, O, N이 있으면 F, O, N의 마이너스(-)
는 -0.8 ~ 0.85 정도가 된다. 이 때 수소(H)와 F, O, N이 서로 당겨져서 결합하는 것을
수소결합이라고 하는데 이는 마치 이온 결합처럼 결합의 강도가 매우 강하다.
라. 분산력
▣ 분산력의 크기는 분자내에서 전자들이 얼마나 유동적인가에 의존
▣ 큰 분자가 더 쉽게 편극될 수 있어 더 큰 순간 쌍극자와 유발 쌍극자를 가지며 전체적으
로 더 큰 분자간 인력을 나타냄
▣ 분산력은 무극성 분자들 사이에만 작용하는 것이 아니라 모든 분자들 사이에서 작용

▣ 무극성 분자는 서로간에 부딪혀서 부딪치는 과정에서 전자와 전자간에는 반발력이 생겨
한쪽으로 쏠리게 된다. 2개의 분자가 부딪히면 표면에 있던 전자는 서로 반발하며 상호
반대 방향으로 이동하게 된다. 무극성 분자의 전자는 골고루 퍼져 있는데 전자가 이동하
여 순간적으로 분자 입장에서는 한쪽은 플러스(+), 다른 한쪽은 마이너스(-)로 대전된
다. 이렇게 해서 생기는 힘, 즉 전자들이 분산되어 생기는 힘은 전자들이 얼마나 잘 움직
이느냐에 따라 결정된다. 이렇게 전자가 한쪽으로 쏠리는 것을 "편극"이라고 한다.
편극은 분자가 클 수록 잘 나타나고 분산력은 무극성 뿐만 아니라 극성에서도 플러스
(+), 마이너스(-)가 있을 때도 전자들이 쏠릴 수 있어서 분산력은 모든 분자들 사이에서 나타난다.
마. 분자간 힘 (분자량이 비슷한 분자들 사이)의 비교
① 극성 분자 - 이온
② 수소결합 (극성분자간 힘의 극대화)
③ 극성 분자 - 극성 분자
④ 무극성 분자 - 이온
⑤ 무극성 분자 - 극성 분자
⑥ 무극성 분자 - 무극성 분자 (분산력, dispersion force)
힘의 세기는 ① > ② > ③ > ④ > ⑤ > ⑥
'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 기체 특성과 기체법칙 - 기초 화학 (0) | 2022.12.01 |
|---|---|
| 탄소화합물 - 기초 화학 (2) | 2022.11.28 |
| 공유결합과 결합의 극성 (기초화학) (0) | 2022.11.25 |
| 이온 결합 물질과 금속 결합 물질 (0) | 2022.11.24 |
| 몰 (mole)과 화학 반응식 (0) | 2022.11.23 |
