【목 차】
1. 공유 결합
2. 전자점 구조
3. 팔전자 규칙
4. 전기 음성도
5. 결합의 극성과 분자의 극성
6. 공유결합 분자의 명명법
1. 공유결합 (Covalent bond)
가. 공유결합의 정의

▣ 공유결합은 금속원소는 해당되지 않고 비금속원소를 대상으로 한다.
▣ 주기율표 왼쪽에 있는 금속원소들은 최외각 전자껍질에 전자가 1개 또는 2개가 있고
이들을 버리기 쉬운데 알루미늄은 3개 있지만 이들은 전자를 버리고 플러스(+) 이온이 된다.
▣ 공유결합은 주기율표 오른쪽 위에 있는 원소들로 전자를 내놓지 않으려고 하는 물질이다.
이런 원자들이 서로 결합을 할 때 팔전자 규칙 즉, 제일 바깥 전자껍질의 전자수를
8개로 맞추기 위해 원자 서로간에 전자를 공동 소유하는 방향으로 결합하는 것이다.
▣ 그런데 수소하고 헬륨은 주기율표 제일 위쪽에 있는데 이들은 제일 바깥쪽 전자껍질이
첫번째 전자껍질이다. 첫번째 전자껍질은 크기가 제일 작아서 최대 전자가 2개 밖에
들어가지 못한다. 따라서 수소와 헬륨은 이런 성질을 가지고 있다.
▣ H2의 그림을 보면 1번 원자핵이 2번 전자를 당기고 2번 원자핵이 1번 전자를 당긴다.
쿨룽의 힘에 따라 (+)와 (-)간의 인력이 대단히 크다. 그와 비슷하게 전자구름내에서
전자들 간의 마이너스(-) 간의 반발력과 원자핵의 플러스 (+)간의 반발력 또한 무시할 수 없다.
▣ 따라서 핵과 전자 사이의 인력이 핵과 핵, 전자와 전자 사이의 반발력 보다 크면 강하게
묶이는 (결합되는) 것이고 이것을 알짜 인력이라 한다. 이럴 때 에너지 변환을 보면 다음과 같다.
나. 공유결합의 에너지 변화
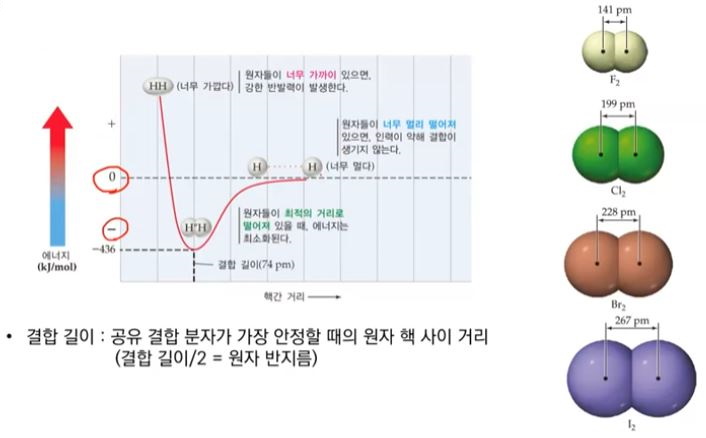
▣ 원자간에 멀리 떨어져 있어서 서로간에 영향을 미치지 않으면 그 때의 에너지는 "0"이 된다.
▣ 화학에서 에너지가 "0"이면 이것은 안정이다. 에너지가 낮다고 부른다. 그리고 아무
것도 일어나지 않는 상태이다.
▣ 결합을 해서 그 물질이 안정해진다는 것은 에너지가 마이너스 쪽으로 내려가는 것으로
이것은 안정해 지는 것을 의미한다. 반대로 에너지가 플러스(+)가 되면 불안정하다는
것을 의미한다.
▣ 수소 원자들이 멀리 떨어져 있어서 영향을 주고 받지 않을 때 그 때 에너지는 "0"이다.
▣ 왼쪽에 있는 원자핵이 오른쪽 전자를 당기고 오른쪽에 있는 원자핵이 왼쪽 전자를 당기는
인력으로 인해서 수소원자의 핵과 핵 사이의 거리가 74 피코미터(pm)가 될 때
이 때 인력이 반발력 보다 훨씬 커서 수소 분자가 가장 안정하게 될 수 있는 상태가 된다.
▣ 이 때 생긴 이 입자를 H2 수소 분자라고 한다.
▣ 수소분자의 원자핵과 원자핵 사이의 거리, 이 거리를 결합길이라고 하고 수소분자 처럼
원자 2개가 하나의 분자가 되는 경우에는 원자 반지름은 결합길이를 2로 나눈 값으로
하기로 화학자들이 약속을 했다.
※ 원자와 원자가 겹치는 부분(전자껍질이 겹치는 부분)이 있더라도 전자는 구름처럼
퍼져 있기 때문에 분명한 경계가 있는 것은 아니다. 따라서 원자 2개가 하나의 분자를
이룰 때 핵간 거리를 2로 나눈 것을 원자 반지름으로 정의하기로 했다.
▣ 또한 플로오린의 경우에는 반지름이 2분의 241 피코미터(pm), 염소는 2분의 199,
브로민은 2분 228, 아이오딘의 반지름은 2분의 267 피코미터(pm)이다.
다. 결합에너지

▣ 기체상태의 분자 1몰의 결합을 끊기 위해서 필요한 에너지를 결합에너지라 한다.
▣ 결합에너지는 항상 양수이고 결합에너지를 흡수하여야 만 물질이 결합할 수 있다.
흡열반응이 일어나야 만 그 결합을 끊을 수 있다.
▣ 예를 들어 탄소와 산소사이의 결합이 하나 있을 때는 결합길이가 143 [pm]이고 끊을 때 358[kJ]이
필요한 반면 탄소와 산소간의 결합이 이산화탄소(CO2)와 같이 결합이 2개면 결합길이가
123[pm]로 짧아지고 결합을 끊을 때 745[kJ]로 에너지를 더 많이 필요로 한다.
▣ 결합에너지를 쓸데는 그 물질의 액체, 고체, 기체 상태가 다르더라도 기체 상태를 전제로 하여
결합에너지를 산정하게 된다.
라. 공유결합 ⇒ 분자 생성

▣ 원자가 공유결합을 하면 분자입자가 새로 생긴다.
▣ 플로우린 원자는 최외각 껍질에 전자가 7개가 있다.
전자 8개를 채워야 안정이 되는데 플로우린 원자 2개가 서로 간에 최외각 전자
하나씩을 서로 공유하기로 함에 따라 이들 전자 2개를 서로 딱 붙여 버린다.
이렇게 전자가 서로 붙어 버린 형태를 분자라고 한다.
▣ 원자와 분자의 구별법은 물질을 구성하는 가장 작은 입자가 원자인데 반해 물의 고유성
질을 띠는 가장 작은 입자를 분자라고 한다.
마. 공유결합의 종류
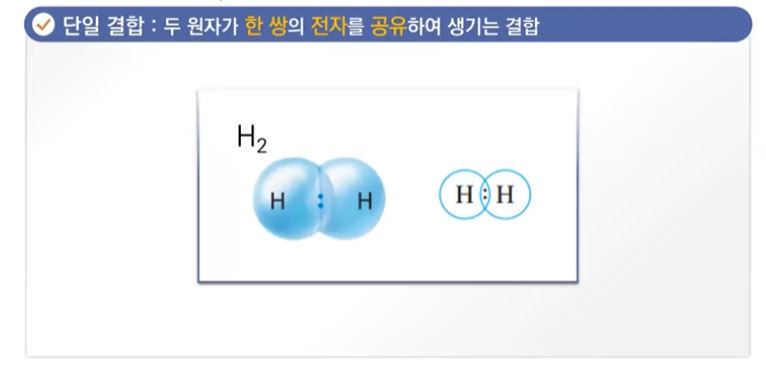
▣ 수소의 경우는 한쌍의 전자를 공유하므로 단일 결합이라고 한다.
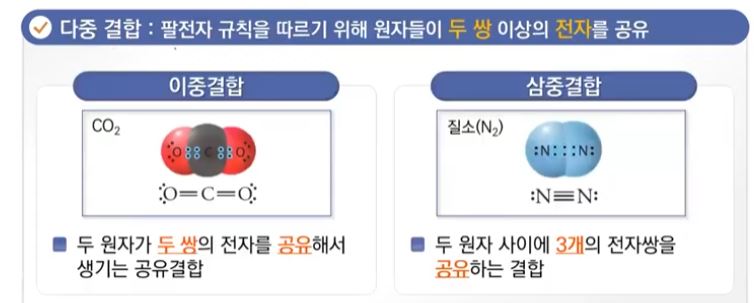
▣ 다중결합은 이중결합과 삼중결합이 있다.
▣ 다중결합은 팔전자 규칙을 만들기 위해서 원자들이 전자 2쌍 이상을 공유해야 한다.
▣ 결합선, 이선으로는 전자 2개 즉 결합하나를 선하나로 표현하므로 결합선은 2개이다.
▣ 질소는 3개의 전자쌍, 질소는 최외각 전자껍질에 전자가 5개가 있는데, 원자간에 서로
전자 3개씩을 공동 소유해야 팔전자 규칙을 충족시킨다. 이를 삼중결합이라 한다.
2. 전자점 구조 (Electron - dot structure)
가. 전자점 구조 또는 루이스 전자점 구조 (Lewis electron dot symbol)
▣ 원소기호 주위에 원자가 전자들 (Valence electrons)을 점으로 나타낸 기호

※ 최외각 전자 ≒ 원자가 전자 (예외 : 18족 원소는 아님)
▣ 원자의 원자가 전자들이 분자에서 어떻게 분포되는가를 점의 위치로 표시함 (공유전자
및 비공유 전자를 모두 표시)
▣ 원자들이 결합을 형성할 때, 완전한 원자가 껍질 (Complete Valence shell) 또는 비활성 기체
전자배치 (noble gas electron configuration)를 만족시키도록 전자를 공유 함 (팔전자 규칙)
▣ 주족 원소의 전자점 수는 족 (1A ~ 8A)의 수와 일치
(전이금속은 내부 껍질이 불안전하기 때문에 Lewis 점 기호를 나타내지 않는다)
나. 주족 원소들의 전자점 구조

다. 전자점 구조의 예시

▣ 공유결합의 화합물을 분자라고 부른다.
▣ 고립 전자쌍 또는 비공유 전자쌍은 같은 말이다.
공유전자쌍을 결합 공유 쌍이라고도 한다.
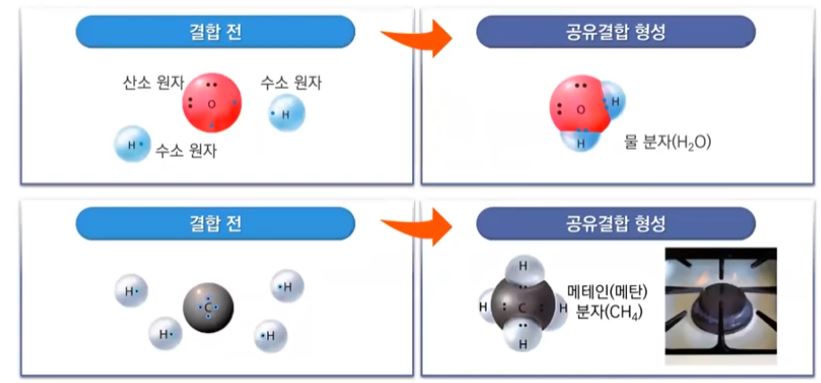
▣ 산소원자는 최외각 전자가 6개이고 수소는 1개 이므로 산소원자 1개와 수소원자 2개가
결합하여 물(H2O)이 된다.
▣ 메테인, 메탄분자는 탄소는 제일 바깥 전자껍질에 전자가 4개인데 수소원자는 전자가
하나이므로 수소원자 4개가 전자를 하나씩 메탄에 주어서 공유함으로써 공유결합을 한다.
라. 꼭 외워야 하는 주족 원소

▣ 수소를 탄소 위에 쓴 것은 탄소(C)는 최외각 전자가 4개이고 규소도(Si) 4개인데 팔전자 규칙의
절반만 채워져 있어서 이 전자 4개를 버리기도 그렇고 가져오기도 애매해서 공유결합을 한다.
▣ 수소는 전자가 하나가 있지만 첫번째 전자껍질에 전자가 최대 2개를 채울 수 있으므로
수소입장에서는 전자가 하나 절반만 채워져 있는 개념이어서 수소는 왼쪽 금속원소와
결합할 때는 전자를 가져와서 마이너스 (-)가 되고 오른쪽 비금속과 결합할 때는 전자를 빼앗겨서
플러스(+), 가운데 있는 원소들 또는 다른 원소들과 이온이 아닌 경우에는
전자 하나를 주는 공유 결합을 할 수 있다.
3. 팔전자 규칙 (Octet rule)
가. 족에 따른 공유결합의 수

▣ 붕소는 수소와 결합하면 보레인(borane)이라는 물질이 되는데 붕소는 최외각 전자가
3개가 있는데 수소 원자 3개와 결합해서 전자 6개만 있어도 안정해지는 특이한 물질이다.
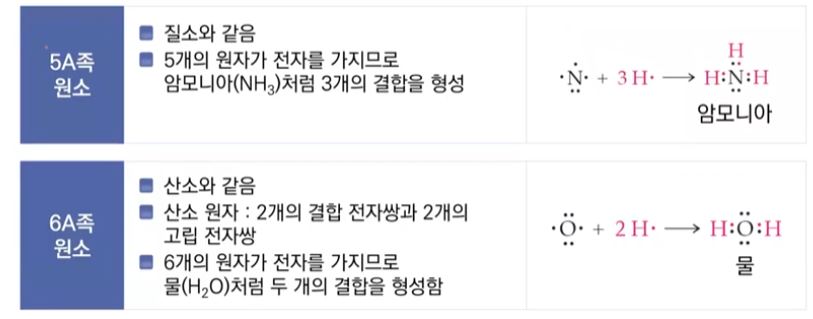
▣ 15족 5A족은 질소는 최외각 전자가 5개 이므로 3개만 채워지면 되므로 3개의 결합을 형성한다.
▣ 산소는 최외각 전자가 6개 이므로 2개만 더 채워지면 되므로 산소는 2개의 결합을 한다.

▣ 기억해야 할 것은
⊙ 14족 C - 4, 15족 N - 3, 16족 O - 2, 17족 F - 1
4. 전기 음성도 (Electronegativity)
가. 전기음성도
▣ 화합물에서 한 원자가 자기 쪽으로 전자를 끌어 당기는 능력의 척도 (원자가 결합 전자를 끌어
당기는 힘의 상대적 크기, 불소(F)의 전기 음성도가 제일 크다)
⊙ 주기율표 왼쪽에서 오른쪽으로 가면서 원소들의 금속성이 감소하기 때문에 전기 음성도는 증가)
⊙ 같은 족에서는 원자 번호가 금속성이 증가할 수록 전기음성도는 감소
⊙ 전이금속은 이러한 경향을 따르지 않음

▣ 전기음성도 : F 4.0 O 3.5 N 3.0
나. 쌍극자 모멘트 (Dipole moment, u)
▣ 결합의 극성을 정량적으로 나타낸 값
⊙ 극성 결합에서 전자의 밀도의 이동은 그 이동의 방향을 나타내는 십자화살(쌍극자 화살)을
Lewis 구조 위에 놓으면서 형상화
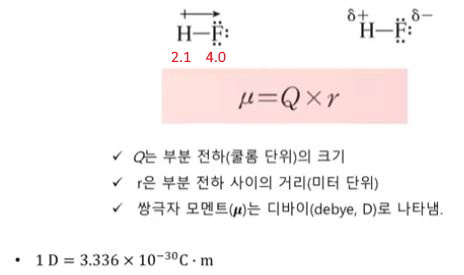
▣ 플러스(+)는 양극을 의미하고 화살표 끝이 마이너스(-)를 의미한다. 화살표 즉 벡터값을 측정해서
전자가 얼마나 세게 당겨지는지를 나타낸 값이 쌍극자 모멘트 μ라는 값이다.
이 μ값은 양성자의 크기에 거리를 곱하여 나타낸다.
이는 debye라는 단위로 나타낸다.
다. 결합의 극성

▣ Cl과 Cl과의 결합은 전자의 쏠림 현상이 없다. 이런 경우를 무극성 공유결합이라 한다.
같은 원자끼리 공유결합을 할 경우 무극성 결합이 된다.
Cl2, H2, O2, N2 등이 그 예이다.
또 하나 있는데 C-H 의 결합도 무극성 결합이다. C와 H은 전기음성도가 2.5, 2.1의
약간의 차이는 있지만 원자 크기 전자궤도 반경 등을 고려하면 음성도가 거의 비슷하다.
실제 실험에서도 전자 쏠림이 거의 없는 것으로 나타났다.
▣ NaCl의 경우에는 Na에 있던 전자가 Cl로 이동해 전기음성도 단위가 2이상 차이가 나서
주로 극성 결합을 띤다. 이런 극성 결합은 이온 결합에서 금속원자와 비금속 원자 결합에서 나타난다.
▣ 다른 원자들간 결합 염화수소의 경우 H와 Cl 그리고 H3N, CCl4 등은 극성 결합이다.
5. 결합극성과 분자의 극성
가. 극성 분자

▣ 결합이 핵의 양성자가 전자를 한쪽으로 쏠리게 하면 극성 공유 결합이 되고 전자가 쏠리지 않으면
무극성 공유결합이 된다.
▣ 극성 분자는 원자핵에 양성자가 N개가 되고 N개의 핵이 전자를 세게 당기게 된다.
▣ 극성분자를 보면 원자핵의 양성자가 전자를 세게 당기게 되니까 결국 알짜적으로 위쪽
으로 당겨지니까 분자 하나로 보면 위가 마이너스(-)가 되고 아래가 플러스(+)가 된다.
아래쪽이 파란색 (+)가 되고 위쪽은 빨간색 (-)가 된다. 이렇게 되면 원자들이 결합전자
를 당기는 인력이 달라져서 전자구름이 한 쪽으로 쏠려서 분자 속에 플러스(+), 마이너
스(-)가 나타나게 된다.
나. 무극성 분자

▣ 무극성 분자는 같은 원자끼리 결합하면 무극성 분자가 된다.
그런데 다른 원자와 결합한 이산화탄소(CO2)는 C와 O가 결합을 했지만 이는 상호 대칭으로
결합을 해서 전자의 쏠림이 없다.
▣ CO2는 결합은 탄소(C) 쪽에서 산소(O) 쪽으로 당겨진다. 탄소를 중심으로 봤을 때
양쪽에서 대칭적으로 같은 힘으로 당겨지므로 분자 전체적으로 보았을 때는 극성을
띠지 않는다. 하지만 결합은 극성이다.
▣ 이산화탄소(CO2)는 결합은 극성이지만, 극성 공유결합이지만 분자는 무극성 분자다.
2개의 벡터를 합하면 "0"이 된다. 사염화 탄소도 마찬가지이다. 결합자체는 전자가
염소 쪽으로 쏠리는 극성 공유결합이지만 분자 자체는 무극성 분자이다.
다. 공유 결합 분자의 특성

▣ 이온 결합은 플러스(+)와 마이너스(-) 원소가 계속하여 연쇄적으로 결합하니까 전기적인 힘으로
강하게 결합되어 녹는 점이 높고 끓는 점도 높으며 모든 원자 사이가 마이너스(-), 플러스(+),
마이너스(-), 플러스(+)... 이렇게 강한 전기적인 힘으로 결합되어 있다.
▣ 공유결합은 HCl, 염화수소 같은 기체 처럼 H+와 Cl-가 강하게 공유결합되어 있으나
이것은 하나의 똑똑 떨어지는 별개의 분자라는 하나의 입자들로 구성되어 있다.
▣ 따라서 분자와 분자들 사이의 인력은 강하지 않다. 그러므로 녹는점은 - 115[℃],
끓는 점은 - 84[℃] 이라서 상온에서 기체로 존재한다. 염화수소는 물에 녹으면 염산이
되므로 이 기체를 잠깐 얼굴에 부딪쳐도 엄청 따갑다.
6. 공유결합 명명법
가. 이성분 분자 화합물 (binary compound)의 명명법

▣ 앞 원소가 플러스(+) 역할, 뒤 원소가 마이너스(-) 역할을 하고 뒤 원소에 ~화를 붙인다.
▣ 우리나라는 뒤 원소를 먼저, 다음 앞 원소를 부른다.
※ 영어는 앞 원소를 먼저 하고 뒤 원소는 ide를 붙인다.
▣ 각 원소의 접두사는 수치 접두사를 사용한다.

[예제] 다음 질소 화합물의 이름은 무엇일까요 ?
[예제] 다음 화합물의 체계적인 이름을 쓰시오.
(1) PCl3 삼염화인
(2) N2O3 삼산화이질소
(3) P4O7 칠산화사인
(4) BrF3 삼플루오린화 브로민 또는 트라이플루오린화 브로민

※ 관용적인 이름 H2O 물, H2O2 과산화수소 NH3 암모니아
NH3는 원래 H3N이 맞는데 이런 경우 일진화삼수소라고 일컬어야 하는데
관행적으로 암모니아라고 부른다.
'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 탄소화합물 - 기초 화학 (2) | 2022.11.28 |
|---|---|
| 분자의 구조와 성질 - 기초 화학 (2) | 2022.11.26 |
| 이온 결합 물질과 금속 결합 물질 (0) | 2022.11.24 |
| 몰 (mole)과 화학 반응식 (0) | 2022.11.23 |
| 주기율표와 원소의 주기적 성질 (2) | 2022.11.22 |
