【 목 차】
1. 반응지수와 평형상수
2. 평형문제 해결
3. 평형이동 : 르샤틀리에 원리
4. 화학평형과 촉매
1. 반응지수와 평형상수
가. 반응지수의 정의
▣ 반응지수 (Qc)는 평형상수식에 현재 실험에서 측정된 실제 농도를 대입한 값을 말한다.
▣ 화학반응이 평형에 도달했는지의 여부와 앞으로 일어날 반응의 방향을 예측하는데에유용하다.
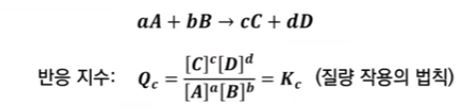
★ 평형 상태에서는 반응지수와 평형상수는 동일한 값이 된다.
▣ 반응지수의 식은 농도평형지수의 식과 같다. 다만, 차이가 있다면 반응지수는 농도가 평
형상수일 때는 Kc 가 평형일 때는 A,B,C,D 농도가 평형이었다. 반응지수는 일반적으로
A농도의 a승, B농도의 b승, C농도의 c승, D농도의 d승 ([A]a, [B]b, [C]c, [D]d) 인데
실제 농도의 값을 넣은 것이 반응지수가 된다.
▣ 일반적으로 반응지수 Qc ≠ Kc 이다. 여기서 다르다는 의미는 예를 들어 평형상수가
1.7×103 이면 실제 실험을 하다가 A,B,C,D 농도를 측정해서 반응지수식에 대입해 보
았더니 반응지수가 0.7×102 이었다면 즉, 반응지수가 평형상수 보다 작은 경우는 모든
화학반응은 평형상태가 되려고 하니까 반응지수가 평형상수 만큼 커질려고 할 것이다.
위 식에서 반응지수가 커질려면 분모는 작아지고 분자는 커져야 하므로 반응물은 작아
지고 생성물은 커져야 한다. 즉, 정방향의 반응이 일어나게 될 것이다. 이렇게 반응의
방향을 예측할 수 있다.
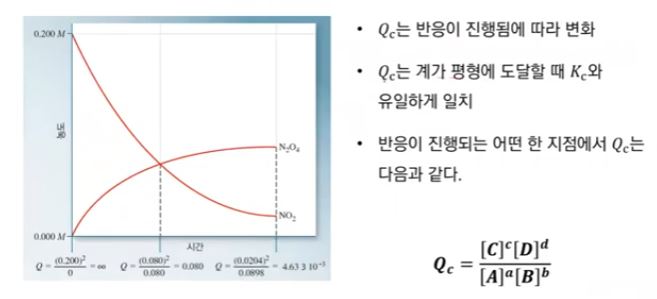
▣ 초기일 때는 N2O2의 농도가 "0"이니까 반응지수는 무한대가 된다 (분모가 "0"이므로)
시간이 지남에 따라 반응지수는 반응물과 생성물의 값이 생기므로 측정할 수 있게 된다.
나. 반응지수의 응용
예) 다음 반응의 결과 1.00[ℓ]의 용기 (430[℃] 일 때) H2 (0.243[mol]), I2 (0.146 [mol]), HI (1.98[mol])가 혼합되어
있다면 이 계는 평형에 도달한 것인지 결정하시오.

2. 평형문제 해결
가. 반응지수와 평형상수의 비교
|
Q < K
|
⊙ 반응물에 대한 생성물의 농도비는 매우 작음
⊙ 평형에 도달하기 위해 생성물로 전환되어야 함
⊙ 이 계는 정방향 (왼쪽에서 오른쪽) 진행
|
|
Q = K
|
⊙ 실제 실험농도는 평형 농도
⊙ 계는 이미 평형상태에 있고 어느 방향이든지 알짜 반응은 없음
|
|
Q > K
|
⊙ 반응물에 대한 생성물의 농도비는 매우 큼
⊙ 평형에 도달하기 위해 생성물은 반응물로 전환되어야 함
⊙ 이 계는 역으로 (오른쪽에서 왼쪽) 진행
|
※ 화학반응은 평형상태(안정상태)에 도달하려고 자발적으로 진행한다.

[풀이]

※ 계산된 Qc 값은 Kc 값보다 작으므로 반응은 평형에 있지 않고 평형에 도달하기 위해
정반응이 우세하게 진행될 것이다.

[풀이]
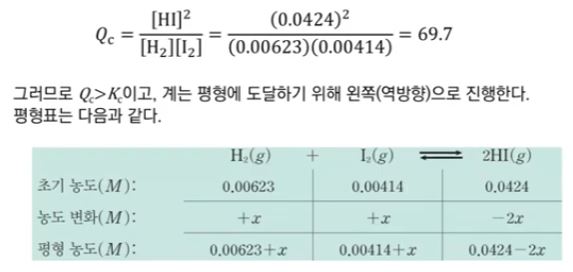
▣ 반응지수와 평형상수를 비교하여 풀어 보면 다음과 같다.

※ 근의 공식으로 풀었을 때 농도는 마이너스(-)가 될 수 없다. 값은 양수여야 한다.
3. 평형이동 : 르 샤틀리에 원리
가. 르 샤틀리에 (Le Chatelier)의 원리
▣ 평형에 있는 화학계가 자극을 받으면 전체 반응은 그 자극을 완화하는 방향으로 진행하여 다시 평형에 도달한다.
※ 화학반응의 평형은 동적 평형이기 때문이다.
▣ 이 때 "자극"은 다음의 방법에 따라 평형에 있는 계를 교란하는 것을 의미한다.
A. 농도변화 (반응물 혹은 생성물의 첨가나 제거)
B. 계의 부피 또는 압력 변화 (반응물과 생성물이 기체인 경우)
C. 온도 변화
※ 농도, 부피, 압력 변화의 경우 평형상수 Kc, Kp는 불변이다. 온도를 변화시키면 평형상수는 변화한다.

나. 농도 변화 (반응물 첨가)

▣ 질소를 첨가하여 농도를 2.05[mol]에서 3.51[mol]로 증가시키면 계는 더 이상 평형상태에 있지 않게 된다.

▣ 반응지수가 평형상수와 같지 않게 되므로 반응지수가 평형상수를 찾아 가도록 화학반응이 확대된다.

※ 평형상태에 있는 계에 반응물을 더 첨가하면 정반응을 통해 새로운 평형에 도달하게 된다.
(농도 변화시 평형상수는 동일하다 !!!)
다. 농도변화 (반응물의 첨가)
▣ Qc가 Kc 보다 작기 때문에 반응은 평형에 도달하기 위해 정반응 (오른쪽)으로 진행
▣ N2와 H2 농도는 감소하고 (반응지수의 분모를 작게 함) NH3 농도는 증가 (반응지수의 분자를 크게함)
▣ Qc가 다시 Kc와 동일하게 될 때 까지 정반응이 우세하게 진행되고 계는 다시 새로운 평형 위치
(equilibrium position)에 도달하게 됨

[풀이]
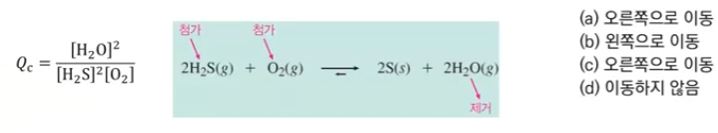
※ 고체는 평형상수를 쓰지 않기 때문에 S(s)를 첨가하면 평형이동과는 관계가 없다.
즉, 평형이동에는 아무런 영향을 주지 않는다.
라. 부피와 압력의 변화
▣ 기체 물질의 압력(농도) 변화 = 반응용기의 부피 변화
▣ 비활성 기체 (반응에 참여 하지 않는 기체)의 첨가 : 평형위치에 영향 없음
(전체 부피는 같기 때문에 반응물과 생성물의 농도는 변하지 않으므로 평형은 교란되지 않고
평형 이동도 일어나지 않음)
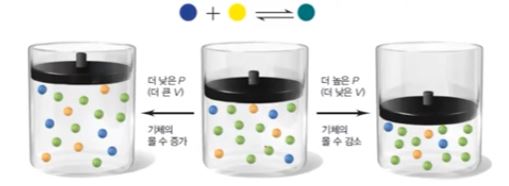
◈ 부피감소 (압력증가) : 총 기체 분자수가 줄어드는 방향
◈ 부피증가 (압력 감소) : 총 기체 분자수가 늘어 나는 방향
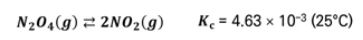
▣ 0.643 M N2O4와 0.0547 M NO2의 평형 혼합물이 들어 있는 반응 용기의 부피를 반
으로 줄이면 각 농도는 2배가 된다. 반응지수를 구하면 다음과 같다.

▣ Qc가 Kc보다 크기 때문에 계는 왼쪽으로 이동해 평형에 도달한다.
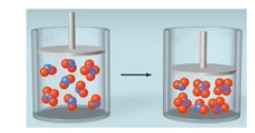
예제) 각 반응에 대해 반응용기의 부피가 감소할 때 어느 방향으로 평형이 이동하는지 예측하시오.
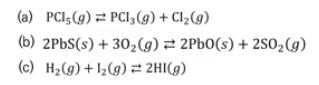
※ 기체의 몰수가 줄어드는 방향으로 반응이 일어난다.
[풀이]
(a) 반응물 쪽은 기체 1[mol], 생성물 쪽은 기체 2[mol] → 왼쪽으로 이동
(b) 반응물 쪽은 기체 3[mol], 생성물 쪽은 기체 2 [mol] → 오른쪽으로 이동
(c) 양쪽 모두 기체 2[mol] → 이동하지 않음
예제) 다음 반응에서 생성물을 더 얻으려면 반응 용기의 부피를 어떻게 변화시켜야 하는가 ?

[풀이]
(a) CO2만 기체이다. 수득율을 증가시키기 위해서는 부피를 늘린다. (압력감소)
(b) 기체가 반응물 쪽에 더 많이 있으므로 부피를 줄인다. (압력증가)
(c) 반응식 양쪽의 기체 몰수가 같으므로 부피(압력)의 변화는 수득률에 아무런 변화를 주지 않는다.
마. 온도 변화
▣ 부피나 농도 변화는 평형의 위치 (즉, 반응물과 생성물의 상대적 양)를 변화시킬 수 있으나
평형상수값은 변화하지 않는다.
▣ 온도의 변화만 평형상수를 변화시킬 수 있다.
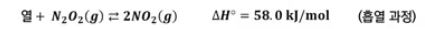
▣ 위 반응에서 온도늘 높이는 것 (열을 첨가)은 정반응쪽으로 평형을 이동시킨다. ⇒ 열이
반응물 쪽에 나타나기 때문이다.
▣ 온도를 낮추는 것 (열을 제거)은 평형을 역방향으로 이동시킨다.
▣ 흡열반응에서 평형상수는 계에 열이 가해지면 증가하고 열이 방출되면 감소한다.

※ 온도 변화만이 평형상수를 변화시킬 수 있다.

※ 표준 생성 엔탈피는 그 물질 1[mol]이 생기는데 필요한 에너지를 말한다.
[풀이]

▣ 발열반응이기 때문에 온도가 증가할 때 평형은 왼쪽으로 이동하고 온도가 내려가면 오른쪽으로 이동한다.
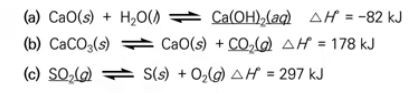
예제) 온도의 증가가 각 반응의 평형상수와 밑줄친 물질들의 평형 농도에 어떤 영향을 줄지 서술하시오.
[풀이]
(a) 역반응 : [Ca(OH)2]와 평형상수는 감소할 것이다.
(b) 정반응 : [CO2]와 평형상수는 증가할 것이다.
(c) 정반응 : [SO2]는 감소하고 평형 상수는 증가할 것이다.
4. 화학평형과 촉매
▣ 촉매는 반응의 활성화에너지를 낮춰서 반응을 촉진한다.
▣ 촉매는 정방향과 역방향 반응의 활성화 에너지를 같은 정도로 낮추기 때문에 평형상수를
바꾸지도 못하고 평형의 위치도 이동시키지 못한다.
▣ 평형에 있지 않은 반응 혼합물에 촉매를 넣으면 평형에 도달하는 시간만 짧아진다.
▣ 평형 혼합물에서 얻어지는 생성물의 양은 촉매의 유무화 상관없이 일정하지만 촉매가
있는 경우 훨씬 시간이 단축되는 효과가 나타난다.
가. 촉매작용

▣ 생성물의 양을 늘리기 위한 평형 이동의 이용
⊙ 암모니아의 농도를 줄인다.
⊙ 부피를 줄인다 (압력을 높인다)
⊙ 온도를 낮춘다.

⇒ 낮은 온도에서 수득률은 높으나 속도가 너무 느려 경제적이지 못하다.
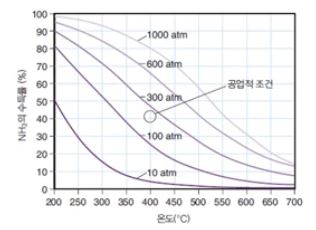
▣ 높은 P와 낮은 T에서, 수율은 높을 것이다. 하지만 속도는 느리다. 공업적인 환경은
200 ~ 300 [atm]에서 존재한다. (약 400 [℃])
'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 산과 염기의 평형 - 기초 화학 (0) | 2022.12.11 |
|---|---|
| 산과 염기 - 기초 화학 (2) | 2022.12.08 |
| 가역반응과 화학평형 (0) | 2022.12.05 |
| 화학 반응 속도 - 기초 화학 (4) | 2022.12.04 |
| 용액의 농도와 묽은 용액의 총괄성 - 기초 화학 (4) | 2022.12.04 |
