【 목 차 】
1. 화학반응속도
2. 속도 법칙과 반응 차수
3. 적분 속도 법칙 : 1차 반응
4. 적분 속도 법칙 : 2차 반응
5. 적분 속도 법칙 : 0차 반응
6. 반응 메커니즘과 속도 결정 단계
1. 화학 반응 속도
▣ 화학반응 속도는 단위시간동안의 반응물 농도 감소량 또는 생성물 농도 증가량으로 정의 된다.
▣ 언제나 양수인 값으로 단지 반응의 빠르기만 판별한다.
⊙ 반응물의 농도 감소량 = -(반응물의 농도 변화량)
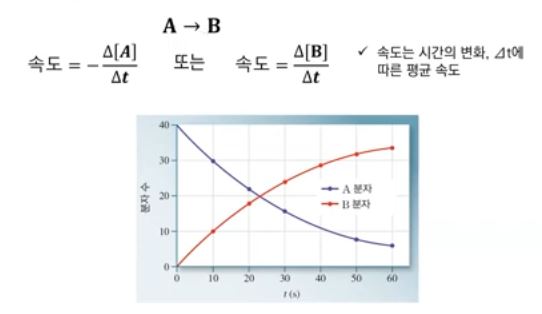
▣ 예를 들어 A가 B로 변하는 반응에서 A는 점점 줄어들고 B는 늘어나야 되는데 화학에서
반응속도는 물리에서 와는 다르게 방향성이 없는 빠르기만 나타낸다.
따라서 항상 양수인 값으로 단지 반응의 빠르기만 판별하기 때문에 반응물의 농도 감소
량은 실제로 반응물의 농도 변화량에 마이너스(-)를 붙인 개념이다. 이렇게 하여 전체적
으로 양수의 값을 만들어 줘야 한다.
▣ 화학에서 반응속도를 측정할 수 있는 방법은 시간분의 농도로 측정할 수 있다.
가. 화학반응의 계수와 반응 속도

▣ 화학반응식에서 A가 2개의 B로 변한다고 하면 한개의 반응에서 물질이 2개가 있는데
예를들어 A가 10개가 없어지고 반응해서 B가 20개가 생긴다면 이 반응에 걸린 시간이
10초라면 A를 기준으로 하면 반응속도는 10/10으로 1이 되고 B를 기준으로 하면
20/10으로 2가 된다. 이는 반응물과 생성물의 속도 차이가 아니고 물질의 계수의
문제이다. 따라서 똑같은 반응식에서 물질의 앞에 있는 계수가 다르면 항상 그 계수로
나누어 반응속도를 산정한다.
위 암모니아 생성식을 보면 질소는 그대로 적용하고 수소는 계수가 3이므로 1/3, 암모
니아는 계수가 2이므로 1/2로 나누어 반응속도를 산정한다.
▣ 일반적인 화학반응에서 반응속도는 각 물질의 계수로 각 물질의 반응속도를 나누어 산정한다.


다른 화학반응식에 대하여 알아 보자.

나. 평균 반응 속도
예) 브로민 분자(Br2)와 폼산(포름산, 개미산)(HCOOH)을 반응시켰을 때 25[℃]에서 브
로민의 농도와 반응속도는 다음과 같이 측정된다.
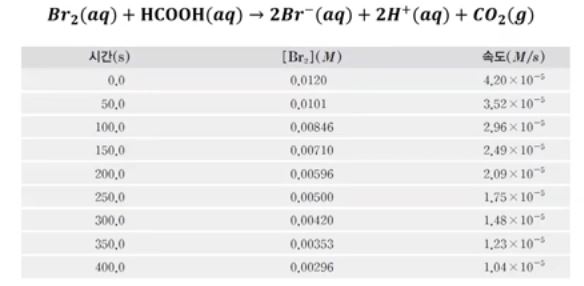
▣ 화학반응 속도에서 평균속도가 있다.
평균속도는 시간이 0초, 50초, 100초, 150초 등의 시간동안 브로민의 양이 얼마나 줄
었는지 측정한 값이다.
다. 평균 반응 속도의 한계
▣ 반응이 진행될 수록 반응물과 생성물의 농도가 달라지므로 속도도 달라진다.

▣ 브로민의 농도와 속도사이에는 비례관계가 성립된다.
라. 순간 속도
▣ 화학에서의 반응속도는 특정 시간에서의 순간속도로 정의한다.
⊙ 역반응에서 오는 복잡함을 없애기 위해 대부분 초기 반응속도로 사용한다.
⊙ 순간 속도는 시간에 따른 반응물 또는 생성물의 농도를 그려낸 그래프에서 접선의
기울기로 측정 가능하다.

※ 화학반응에서 항상 정반응만 생기는 것이 아니라 역방향의 반응도 함께 일어난다. 모든
화학반응은 가역반응이기 때문에 역반응도 함께 일어난다. 모든 화학반응은 가역반응
이기 때문에 역반응도 함께 일어난다.
마. 속도 상수

▣ 속도상수 k는 반응물중에 실제 반응을 하는 물질의 비율을 결정하는 상수이다. 처음부
터 모든 반응물이 반응에 참여하는 것은 아니다.
▣ 속도상수 k는 다음곽 ㅏㅌ이 구할 수 있다.

2. 속도법칙과 반응차수
가. 속도법칙

나. 속도법칙의 실험적 결정

※ 속도의 법칙은 농도와 반응속도만 나타내는 것이지 시간이 얼마 지났을 때 반응물이
얼마남았는지는 알 수 없다. 이것이 화학반응 속도의 한계이다.
다. 속도상수의 단위

▣ 이를 종합하면 다음과 같다.

라. 적분속도법칙 : 0차, 1차, 2차 반응
▣ 0차 반응

▣ 1차 반응
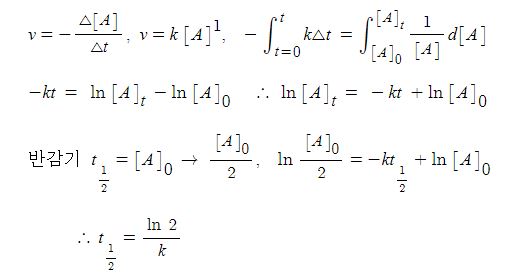
▣ 2차 반응

▣ 0차, 1차, 2차 반감기의 의미는 우리가 밥을 먹었을 때 소화되는 시간을 계산하게 되면
0차 반응은 1그릇 먹었을 때 소화되는데 1시간이 걸린다면 2그릇 먹으면 2시간이 걸리
게 된다. 그런데 1차 반응은 항상 상수이다. 한그릇을 먹든 두 그릇을 먹든 소화되는데
걸리는 시간은 같다. 2차 반응은 한그릇을 먹었을 때 1시간 걸렸다면 두그릇을 먹었을
때는 30분으로 줄어드는 개념이다.
3. 적분 속도 법칙 : 1차 반응
가. 일차반응

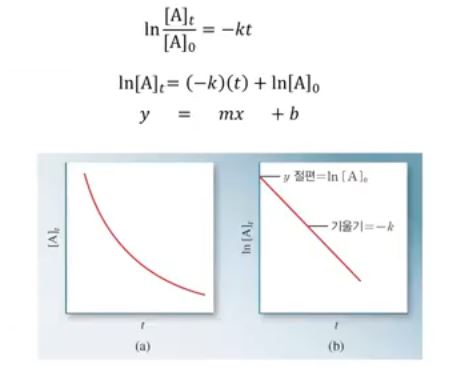
※ 1차 반응이 중요한 것은 대부분 화학반응 물질의 농도를 대부분 ln으로 표현한다.
실제 물질의 양이 자연상수에 따라 줄어들고 또한 생성물도 자연상수에 따라 늘어나기
때문이다. 증가나 감소가 자연상수의 곡선에 따라 변하므로 자연상수 즉 ln을 통해
변화량을 예측할 수 있다.

나. 일차 반응 반감기
▣ 반감기(half-life, t1/2)는 반응물 농도가 원래 값의 절반으로 떨어지는데 필요한 시간을 말한다.



▣ 700[℃] 에서 에테인 분해 반감기는 21.5분이다.
4. 적분속도 법칙 : 2차 반응
가. 이차 반응
▣ 반응속도가 반응물 농도의 제곱에 비례하는 반응을 말한다.

▣ 적분공식을 이용하면 다음과 같은 식을 얻을 수 있다.
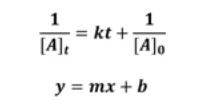
▣ 위 식에서 기억할 것은 기울기가 플러스(+)라는 것이다.
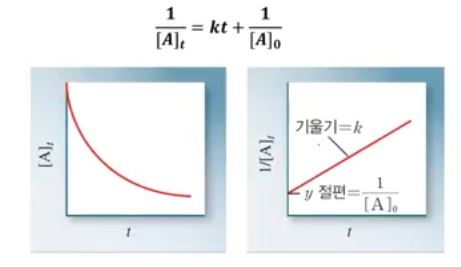
▣ 0,1차 반응식은 기울기가 마이너스(-)인데 2차 반응식은 기울기가 플러스(+)이다.
나. 이차반응의 반감기
▣ 이차 반응에서 반감기(half-life, t1/2)는 다음과 같이 구할 수 있다.

▣ 농도와 무관한 일차 반응의 반감기와 다르게 이차반응의 반감기는 초기 반응물의 농도에 반비례한다.


5. 적분 속도 법칙 : 0차 반응
가. 영차 반응 (Zeroth - order reaction)의 속도
▣ 영차반응의 속도는 반응물 농도와 무관하게 일정하다.

▣ 0차 반응의 반감기

▣ 꼭 외우자 !!!

6. 반응 메커니즘과 속도 결정단계
가. 반응 메커니즘 (reaction mechanism)
▣ 반응물로 부터 생성물까지의 실제 경로를 기술하는 단계별 반응의 순서
▣ 반응 메커니즘에서 하나의 단계는 단일 단계 반응 (elementary reaction) 또는 단일단계(elementary step)라고 한다.

▣ 단계 1에서는 NO2와 NO2가 충돌하여 반응을 하고 단계2는 단계1에서 나온 NO3라
는 물질과 또 다른 CO가 반응을 해서 이제 물질이 생기는 것인데 이 각각의 단계를
더하면 전체 반응이 나와야 하는데 NO3의 경우는 전체 반응이 없다. 전체 반응에 없는
데 생성되었다 없어지는 이런 물질을 중간체라고 한다.
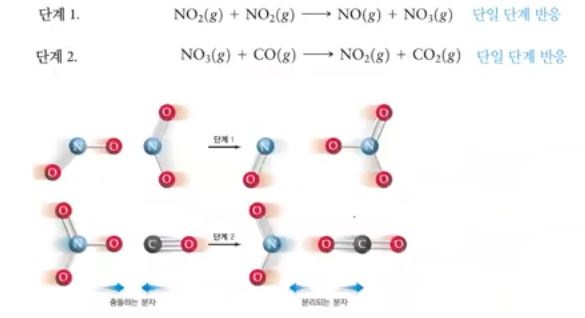
▣ 제안된 반응 메커니즘에서 단일 단계들의 합 = 전체 반응
▣ 반응 중간체 (Reaction intermediate)
⊙ NO3 처럼 반응 메커니즘의 한 단계에서 형성되고 다음 단계에서 소모되는 화학종
⊙ 중간체는 전체 반응식에서 나타나지 않고 분리 가능한 분자인 경우도 있으나 불안정하
여 분리가 어려운 화학종인 경우가 일반적임

나. 속도결정단계 (rate-determining step)
▣ 단일 단계중 가장 느린 단계로 전체 반응의 속도를 결정하는 단계

'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 평형상수와 르샤틀리에 원리 - 기초 화학 (2) | 2022.12.06 |
|---|---|
| 가역반응과 화학평형 (0) | 2022.12.05 |
| 용액의 농도와 묽은 용액의 총괄성 - 기초 화학 (4) | 2022.12.04 |
| 액체와 고체의 성질 - 기초 화학 (2) | 2022.12.02 |
| 기체 특성과 기체법칙 - 기초 화학 (0) | 2022.12.01 |
