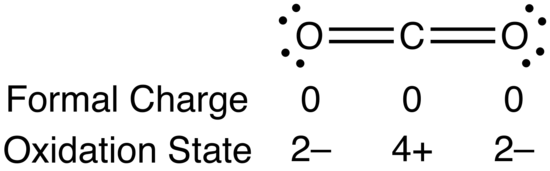
화학의 기본이 되는 핵심 개념 중 하나인 산화수에 대해 알아 봅시다.
산화수는 화합물 내에서 원소의 산화 또는 환원 상태를 나타내는 중요한 지표로서,
화학 반응을 이해하는 데 필수적인 개념입니다.
산소가 화학반응하는 하는 것 뿐만 아니라 일상적인 화학 반응에서도 산화수가 어떻게 작용하는지
그 중요성과 변화 과정을 함께 살펴 봅시다.
쉽고 명확한 설명을 통해 산화수가 무엇인지,
이를 통해 화학 반응을 어떻게 분석할 수 있는지 알아보겠습니다.
산화수의 개념과 중요성
산화수는 화합물이나 이온에서, 원자가 가지고 있는 전자의 상태를 설명해 주는 숫자입니다.
간단히 말해서, 이 숫자는 해당 원소가 전자를 얼마나 많이 잃었거나 얻었는지를 나타냅니다.
더 나아가, 이 산화수를 통해 화합물 내에서의 원자 간 전하 분포를 이해할 수 있으며,
화학반응이 산화인지 환원인지를 판단하는 기준이 됩니다.
따라서 적절한 산화수를 파악하고 이해하는 것은 화학 반응을 예측하고 설명하는 데 매우 중요합니다.
산화수 결정 방식 및 의미
산화수를 결정하는 방식은 몇 가지 기본 규칙에 따릅니다.
예를 들어 순수한 원소의 산화수는 언제나 "0"이 되고,
이온화된 원소의 산화수는 이온의 전하와 같습니다.
또한, 복합 이온이나 화합물에서는 전체 산화수의 합이 "0"이 되거나 이온의 전하와 같아야 합니다.
이러한 규칙을 적용하여 각 원소의 산화수를 결정함으로써, 화합물의 화학적 특성을 파악할 수 있습니다.
위에서 말한 내용을 다시 정리하면
▣ 산화수는 화학 반응에서 물질이 가지는 전하의 상대적인 양을 나타내는 값입니다.
▣ 이온 결합 : 양이온과 음이온이 결합하여 이루어지는 결합으로,
양이온의 산화수는 + 전하량과 같고, 음이온의 산화수는 - 전하량과 같습니다.
▣ 공유 결합 : 원자들이 전자쌍을 공유하여 이루어지는 결합으로,
공유 전자쌍을 이루는 전자들은 두 원자가 공유하므로 어느 한 쪽의 산화수라고 말할 수 없습니다.
하지만, 공유 결합을 이루는 원자들 중에서도 전기음성도가 큰 원자가 전자를 더 많이 끌어당기므로,
전기음성도가 큰 원자의 산화수는 상대적으로 크다고 할 수 있습니다.
▣ 산화수가 변하는 반응을 산화 - 환원 반응이라고 합니다.
⊙ 산화 반응 : 물질이 산화수가 증가하는 반응입니다.
⊙ 환원 반응 : 물질이 산화수가 감소하는 반응입니다.
▣ 산화 - 환원 반응은 화학 반응에서 중요한 역할을 하며, 우리 주변에서 일어나는 다양한 화학 반응에서 발생합니다.
또한, 산화-환원 반응은 화학 전지, 금속의 제련, 화학 물질의 합성 등 다양한 분야에서 활용됩니다.
【산화수 규칙】
산화수 계산 규칙은 다음과 같습니다.
① 홑원소 물질의 산화수는 0입니다.
예를 들어, 탄소(C)는 홑원소 물질로, 산화수가 0입니다.
② 1원자 이온의 산화수는 전하와 동일합니다.
예를 들어, 수소 이온(H+)은 1원자 이온으로, 전하가 +1이므로 산화수가 +1입니다.
③ 화합물의 모든 원자의 산화수 총합은 0입니다.
예를 들어, 물(H2O)에서 수소(H)의 산화수는 +1이고, 산소(O)의 산화수는 -2이므로,
두 원자의 산화수 총합은 0입니다.
④ F의 산화수는 항상 -1입니다.
이는 플루오린(F)의 전기음성도가 크기 때문입니다.
⑤ H의 산화수는 +1입니다.
다만, 금속과 결합할 때는 -1이 됩니다. 예를 들어, NaH에서 수소의 산화수는 -1입니다.
⑥ 다원자 이온의 산화수는 이온의 전하와 같습니다.
예를 들어, 황산 이온(SO42-)에서 황(S)의 산화수는 -2이고, 산소(O)의 산화수는 -2이므로, 이온의 전하와 같습니다.
【화합물의 산화수】
산화수 규칙을 이용하여 산화수를 계산할 수 있습니다.
예를 들어, 다음과 같은 화학 반응식에서 산화수를 계산해 봅시다.
NaCl + AgNO3 → AgCl + NaNO3
NaCl에서 나트륨(Na)의 산화수는 +1이고, 염소(Cl)의 산화수는 -1입니다.
AgNO3에서 은(Ag)의 산화수는 +1이고, 질소(N)의 산화수는 +5이며, 산소(O)의 산화수는 -2입니다.
AgCl에서 은(Ag)의 산화수는 +1이고, 염소(Cl)의 산화수는 -1입니다.
NaNO3에서 나트륨(Na)의 산화수는 +1이고, 질소(N)의 산화수는 +5이며, 산소(O)의 산화수는 -2입니다.
위의 반응에서 나트륨은 산화수가 +1에서 0으로 감소했으므로 환원되었고, 은은 산화수가 0에서 +1로 증가했으므로 산화되었습니다.
【 산화수의 계산 】
① H2O
가장 보편적인 용매인 물의 산화수에 대해 알아 봅시다.
홑원소의 산화수는 이온의 전하와 동일하므로 O의 산화수는 -2 가 됩니다.
이 때 H의 산화수는 +1이 되어야 화합물의 총합이 "0"이 됩니다.
(산화수 -2인 O 1개, 산화수가 +1인 H 2개를 더하면 0)
② Fe2O3
O의 산화수는 -2가 됩니다. 이 때, Fe의 산화수는 +3이 되어야 총합이 "0"이 됩니다.
(산화수가 -2인 O 3개, 산화수가 +3인 Fe 2개를 더하면 0)
③ ClF5
F의 산화수는 -1 입니다. 그러므로 Cl의 산화수는 +5가 됩니다.
④ KMnO4
K, Mn, O4 이 세 원소로 나누어 생각하면 됩니다.
O의 산화수는 -2이고, K의 산화수는 +1입니다. 그러므로 남은 Mn의 산화수는 +7이 됩니다.
⑤ NH4+
H의 산화수는 +1입니다. 하지만 암모니아기 NH4+는 +1 이온이기에 원자의 산화수 총합이 +1 이어야 합니다.
그러므로 N의 산화수는 -3 입니다.
⑥ NO3-
O의 산화수는 -2입니다. 산화수 총합이 -1 이어야 하므로 N의 산화수는 +5 입니다.
【산화 · 환원 반응식에서 산화수 활용】
이제 화학반응식에서 어떤 물질이 산화반응을 일으켰고, 어떤 물질이 환원반응을 일으켰는지 알아봅시다.
산화수가 증가하면 산화반응이 일어난 것이고 산화수가 감소하면 환원반응이 일어 난 것입니다.
다음 몇가지 산화 · 환원반응식을 살펴 봅시다.
Fe2O3 + 3C → 2Fe + 3CO
반응전 : 홑원소 C의 산화수는 "0"입니다. O의 산화수는 -2 이므로 Fe는 +3의 산화수를 갖게 됩니다.
반응후 : Fe의 산화수는 "0"입니다. O의 산화수는 -2이고 C의 산화수는 +2가 됩니다.
∴ Fe는 산화수가 감소하였고, C는 산화수가 증가하였으므로 Fe2O3는 환원반응을 하였고, C는 환원반응을 한 것입니다.
Zn + CuSO4 → ZnSO4 + Cu
반응전 : Zn의 산화수는 "0"입니다. O의 산화수는 -2이고, Cu의 산화수는 +2 이므로 S의 산화수는 -6이 됩니다.
반응후 : Zn의 산화수가 +2로 증가하였고, O의 산화수는 그대로 -2이므로 S의 산화수는 -6 입니다.
Cu의 산화수는 "0"이 되었습니다.
∴ Zn은 산화수가 증가하였고, Cu는 산화수가 감소하였으므로 Zn은 산화반응을 하였고 CuSO4은 환원반응을 한 것입니다.
CO + H2O → CO2 + H2
반응전 : O의 산화수는 H2O와 CO에서 모두 -2 입니다.
따라서 C의 산화수는 +2이고, H의 산화수는 +1입니다.
반응후 : C의 산화수가 +4로 증가하였고 H의 산화수는 "0"으로 감소하였습니다.
∴ C는 산화수가 증가하였고, H는 산화수가 감소했으므로 CO는 산화반응을 하였고, H2O는 환원반응을 하였습니다.
#산화수 #산화반응 #환원반응 #산화환원반응 #홑원소 #화합물 #화학반응 #이온결합 #공유결합
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 물의 전기분해 원리를 알아 보자.. (0) | 2024.12.03 |
|---|---|
| 당량과 당량수 (2) | 2024.12.03 |
| 몰농도, 몰랄농도, 퍼센트 농도 구하기 (0) | 2024.12.02 |
| 몰 (Molar) 농도 계산하기 (0) | 2024.12.02 |
| 당량 : 당량은 화학반응으로 결정된다. (2) | 2024.11.24 |



























































