1. 이온결합
가. 이온결합의 형성
▣ 금속 원소와 비금속 원소 사이에 이루어지는 결합으로서 전기 음성도 차이가 클 때에 일어난다.
아래 그림에서 Na는 전자를 Cl에게 줌으로써 Na+, Cl은 전자를 받음으로써 Cl-로 되어 정전기적 인력으로 이루어지는
이온결합 상태를 완성한다.

Na + 에너지 → Na + + e- (Cl + e- → Cl-)
|
이온결합 ⇒ 금속성이 강한 원소와 비금속성이 강한 원소와의 결합
일반적으로 금속은 양이온으로 되기 쉽고 비금속은 음이온으로 되기 쉽기 때문에
금속과 비금속 물질과의 결합은 이온 결합인 경우가 많다.
|
나. 이온결합과 에너지
▣ (+), (-) 이온간의 정전기적 인력과 전자껍질간의 반발력에 의해 전체 에너지가 최소가 되는 거리에서 이온결합이
형성된다.

다. 이온결합 물질의 성질
① 금속 원소와 비금속 원소 사이의 결합형태이다.
② 이온 간의 인력이 강하여 융점이나 비등점이 높은 고체이며, 휘발성이 없다.
③ 물과 같은 극성 용매에 잘 녹는다.
④ 고체상태에서는 전기 전동성이 없으나 수용액 상태 또는 용융상태에서는 전기 전도성이 있다.
⑤ 외부에서힘을 가하면 쉽게 부스러진다.
2. 공유 결합
▣ 전기 음성도가 거의 비슷한 두 원자가 스핀 (spin)이 서로 반대인 원자가전자를 1개씩 제공하여 한쌍의 전자대 (쌍)를
이루어 이것을 공유함으로써 안전한 전자배치로 되어 결합하는 화학결합을 공유결합이라 한다.

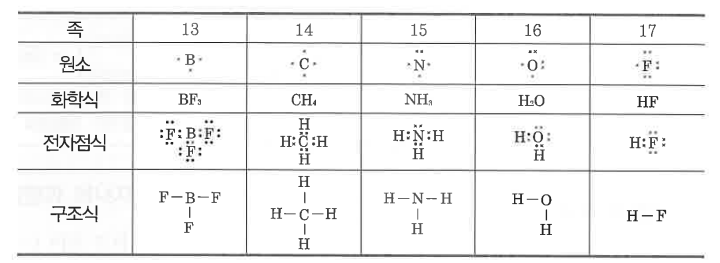
가. 가표의 종류
▣ 전자대 ( : )를 간단히 - 가표 (Bond)로도 표시한다.
① 전자대로 표시한 화학식은 전자식, 가표로 표시한 화학식은 구조식이라 한다.
② 한 원자가 가지는 가표의 수를 공유결합 원자가라 한다.
③ 가표 (bond)의 종류에는 다음의 세 가지가 있다.

나. 전자 구조식
▣ 구조식에서 공유결합을 하고 있는 부분은 그대로 두고, 비공유 전자대를 가지는 원자에 대해서만 이 비공유 전자대를
표시한 화학식을 전자구조식이라 한다.

① 공유결합의 형성 : 비금속 원자들이 각각 원자가전자 (최외각전자)를 내놓아 전자쌍을 만들고, 이 전자쌍을 공유함으로
써 형성되는 결합이다.

② 공유결합의 표시
㉠ 루이스 전자점식 : 원자가전자를 점으로 표시
㉡ 구조식 : 공유 전자쌍을 결합선으로 표시
③ 공유결합 에너지
㉠ 공유결합 화합물 1몰(mol)의 결합을 끊어서 각각의 원자로 만드는데 필요한 에너지을 말한다.
1몰의 H2 (g) + 435 H(g) → H (g) + H (g)
㉡ 결합에너지와 결합길이
⊙ 결합에너지가 클수록 결합길이는 짧다.

④ 종류
㉠ 극성 공유결합 (비금속+비금속) : 서로 다른 종류의 원자 사이의 공유결합으로, 전자쌍이 한쪽으로 치우쳐 부분적으
로 (-)전하와 (+)전하를 띠게 된다. 주로 비대칭 구조로 이루어진 분자이다.
ex : HCl, HF 등
㉡ 비극성 공유결합 (비금속 단체) : 전기 음성도가 같거나 비슷한 원자들 사이의 결합으로 극성을 가지지 않아 전기적으
로 중성인 결합이며 단체 및 대칭 구조로 이루어진 분자이다.
ex : Cl2, O2, F2, CO2, H2 등
㉢ 탄소화합물
ex : 가솔린( C5~C9의 포화 · 불포화 탄화수소)과 물이 섞이지 않는 이유는 물은 극성 공유결합이고, 가솔린은 비극성
공유결합이기 때문이다.
⑤ 공유결합 물질의 성질
㉠ 녹는점과 끓는점이 낮다. (단, 공유 결정은 결합력이 강하여 녹는 점과 끓는 점이 높다.)
㉡ 전기 전도성이 없다. 즉, 모두 전기의 부도체이다.
㉢ 극성 공유결합 물질은 극성용매 (H2O)에 잘 녹고, 비극성 공유결합 물질은 비극성 (C6H6, CCl4, CS2 등)에 잘
녹는다.
㉣ 반응속도가 느리다.
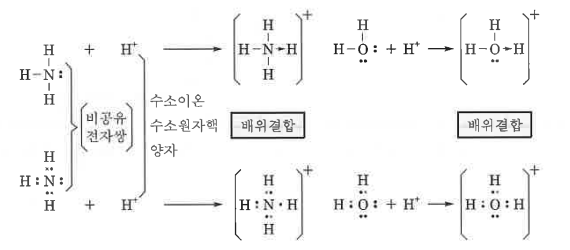
3. 배위결합
▣ 비공유 전자쌍을 가지는 원자가, 이 비공유 전자쌍을 일방적으로 제공하여 이루어진 공유결합을 배위결합이라 하며
화살표 기호 (→)로 표시한다.
ex : 암모늄 이온 (Ammonium ion, NH4+)은 암모니아 (Ammonia, NH3) 가스를 염산용액에 통할 때 염화암모늄이 생성
되면서 생기는 라디칼임
NH3 + HCl → NH4Cl
이것을 이온 방정식으로 표시하면
NH3 + H+ +Cl- → NH4+ + Cl-
즉, NH3 + H+ → NH4+ 로 된다.
4. 금속결합
▣ 금속 단체일 경우 최외각 전자를 내어 놓고 양이온 상태로 되어서 전자를 사이에 두고 간접적으로 이루는 결합형태로
이때 쫓겨 나온 전자를 자유전자라 하며, 이는 전기의 좋은 양도체이다. 이러한 결합을 금속결합이라 하며 이 때 전자
는 금속 속에서 자유롭게 움직일 수 있으므로 자유전자라 한다.

5. 분자구조
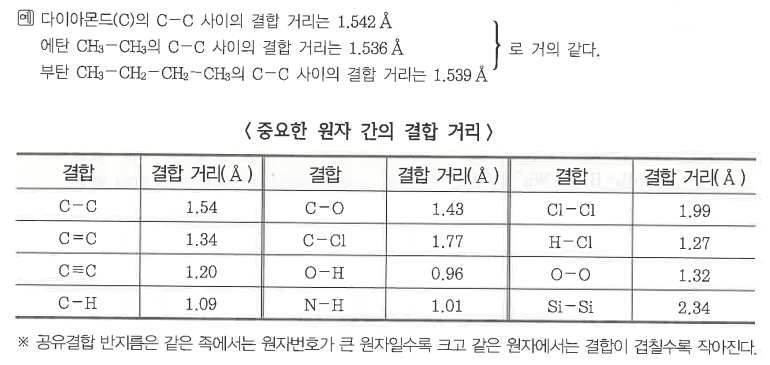
가. 결합거리
▣ 공유 결합을 이루고 있는 원자의 핵과 핵 사이의 거리를 결합거리라 하며, 또한 이 결합거리는 동일한 원자 사이의
결합일 때와 결합의 형식이 같을 때에는 분자나 결정의 종류와는 관계없이 거의 일정하다.
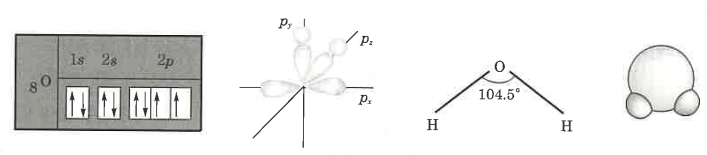
나. 결합각
① H2O의 분자 구조 (V자형 : p2형) : 산소 원자를 궤도함수로 나타내면 그림과 같이 3개의 p궤도 중 쌍을 이루지 않는
전자는 py, pz 축에 각각 1개씩 있으므로 부대전자가 2개가 되어 2개의 수소원자와 py, pz 축에서 각각 공유되며
그 각도는 90° 이어야 하나 수소 원자간의 척력이 작용하여 104.5°의 각도를 유지한다. 이것을 V자형 또는 굽은자형이
라 한다.
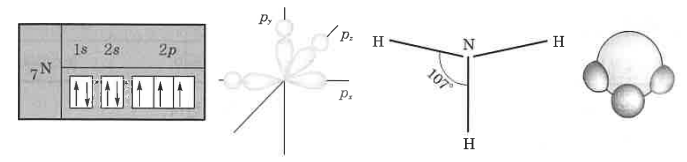
② NH3의 분자 구조 (피라미드형 : p3형) : 질소 원자는 그 궤도함수가 1s2, 2s2, sp3로서 2p궤도 3개에 쌍을 이루지 않은
전자 (부대전자)가 3개여서 3개의 H 원자의 1s1과 공유결합을 하여 Ne형의 전자배열을 만든다. 이 때 3개의 H는
N 원자를 중심으로 그 각도는 이론상 90° 이나 실제는 107°를 유지하여 그 모형이 피라미드형을 형성한다.
③ CH4의 분자 구조 (정사면체형 : sp3형) : 정상상태의 C는 1s2, 2s2, 2p2의 궤도함수로 되어 있으나 이 탄소가 수소와
화학결합을 할 때는 약간의 에너지를 얻어 2s궤도의 전자 중 1개가 2p로 이동하여 여기상태가 되며 쌍을 이루지
않은 부대전자는 1개의 2s와 3개의 2p로 모두 4개가 되어 4개의 H원자와 공유결합을 하게 되어 정사면체의 입체적
구조를 형성한다. 이와같이 s와 p가 섞인 궤도를 혼성궤도 (hybridization)라 한다.

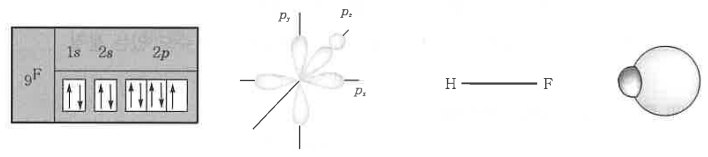
④ HF의 분자 구조 (선형 : p형) : 플루오르 원자를 궤도함수로 나타내면 그림과 같이 3개의 p궤도 중 쌍을 이루지 않은
전자 (부대전자)는 pz 축에 1개가 있으므로 수소 원자로 부터 1s1을 공유하여 완전한 결합 공유 전자쌍을 이룬다.
이 때, F원자는 Ne와 같은 전자배열을 형성하며, H원자는 He와 같은 전자배열을 형성하여 안정한 상태가 된다.
따라서, 플루오르와 수소원자는 서로 직선으로 결합된다.
#공유결합 #이온결합 #배위결합 #금속결합 #결합각 #피라미드 #분자 #암모늄 #전자구조식 #삼중결합
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 산화 · 환원 반응 (화학반응) (6) | 2024.11.17 |
|---|---|
| 용액과 용해도 (0) | 2024.11.13 |
| 산과 염기 (2) | 2024.11.12 |
| 원자의 구조와 원소의 주기율 (8) | 2024.11.07 |
| 물질의 상태와 변화 (6) | 2024.11.06 |
비버리님의
글이 좋았다면 응원을 보내주세요!
