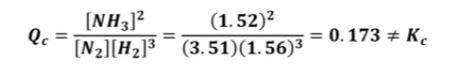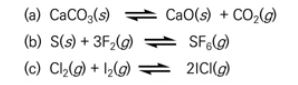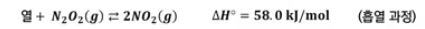1. 가역반응과 비가역 반응
가. 가역반응
▣ 정반응(반응물에서 생성물)과 역반응(생성물에서 반응물)이 모두 일어나는 반응
나. 모든 화학반응 : 원론적으로 가역반응
다. 비가역 반응
▣ 역반응이 너무 느리거나 조금 일어나서 정반응만 일어나는 것 처럼 보이는 반응

※ 비가역 반응의 예로 이온결합 물질이 침전되는 경우로 이 앙금은 물에 잘 녹지 않아 앙금이 생기는 것이므로 역반응이
거의 일어나지 않는다. 이 앙금의 경우에는 10-15 비율로 역반응이 일어난다.
※ 강산과 강염기가 만나 중화반응을 하는 경우로 강산과 강염기는 100[%] 이온화 할 수 있는 물질이고 이온화하여 H와
OH가 만나 물이 되는데 물은 자연상태에서 오억5천오백만개 중의 하나만 역반응이 일어난다.
약산인 아세트산 (CH3COOH)은 1.3[%] 만 이온화되어 불안정하다.
즉, 약산이 들어 있는 물질의 중화반응은 불안정하여 물을쪼개서 원래의 산으로 가려는 성향이 있어 가역 반응을 한다.
※ 비가역 반응에는 기체 생성반응으로 연소가 되어 날아가 버리는 경우와 금속이 산화되는 반응이 있다.
2. 화학평형
가. 화학평형
▣ 정반응의 속도와 역반응의 속도가 같아져서 외부에서 보기에 변화가 없는 것 처럼 보이는 상태를 화학평형이라 한다.

※ 실제 화학반응은 동적 평형 상태이다. 실제 반응은 계속 일어나고 있는데 정반응과 역반응의 속도가 같아서 반응이
일어나고 있지 않는 것 처럼 보이는 것 뿐이다.
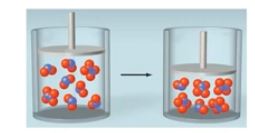
나. 포화용액의 동적 평형

▣ 포화용액의 동적 평형은 다 녹지 못한 용질과 용해된 물질 사이에 계속하여 왔다 갔다하는 상태를 말한다.
다. 포화용액의 동적 평형의 예시

▣ 물에 흰설탕을 녹이면 전체적으로 투명한 물이 된다. 이 때 흰설탕이 남아 있는 것은 포화용액이 되었기 때문이다.
여기에 노란색 각 설탕을 넣으면 만약에 포화용액이 다 녹아서 더 이상 녹지 않는 개념이라면 노란색 설탕을 넣어도
더 이상 녹지 않아야 되는데 노란색 설탕을 넣으면 노란색 설탕물로 변한다.
그 이유는 노란색 설탕이 용해되면 그 만큼 흰설탕이 석출되는 반응이 반복되기 때문이다.
즉, 계속하여 녹고 석출되는 과정이 반복된다. 이런 과정을 통해 연한 노란색이 되고 이렇듯 화학반응의 평형은 동적평
형이라고 할 수 있다.

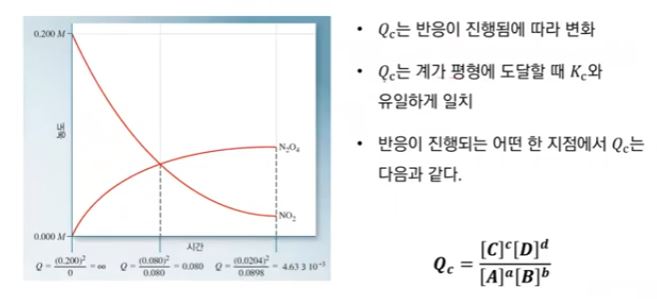
▣ N2O2 와 NO2 실험의 예를 많이 드는 이유는 색깔이 무색과 갈색으로 뚜렷하기 때문이다.
무색인 비어커는 N2O2 만 있다는 것이고 갈색이 짙어진다는 것은 NO2 가 생긴다는 것이다.
평형상태는 반응물의 농도와 생성물의 농도가 같아지는 상태를 말한다.
▣ 평형은 초기에 반응물 또는 생성물만 있어도 도달이 가능하며 초기에 반응물과 생성물의 혼합물이 있는 경우에도 상관
없이 평형상태에 도달한다. 평형상태에는 반응물과 혼합물이 함께 있는 상태이다.
3. 평형상수
가. 평형
▣ 정방향과 역방향 반응속도가 동일하게 진행되는 상태를 말한다.

※ Kc 를 평형상수라고 부를 수 있는 이유는 반응물 농도와 생성물의 농도는 변하지 않으 므로 일정한 값이 된다. 분모는
반응물 농도, 분자는 생성물 농도이며 물질의 계수는 차수로 올려 지수가 된다.
[ ]안은 몰농도이며 몰농도 제곱을 물농도로 나누었는데 단위에 몰농도가 남아있지 않은 것은 몰농도는 단위가 없기
때문이다. 평형일 때 농도 그 숫자만 사용하기 때문이다.
나. 평형 농도를 이용한 평형상수 계산 (실험적 근거)

다. 평형상수 계산

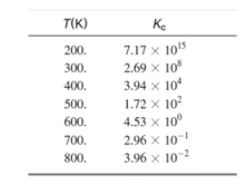
▣ 74[℃]에서 이 반응의 Kc = 216 이다.
라. 평형상수의 크기로 부터 알 수 있는 사실

마. 불균일 평형
▣ 불균일 (heterogeneous) 평형
⊙ 가역적 화학반응에서 화학종이 모두 같은 상이 아닐 때의 평형

⊙ 평형 상수식에 단위가 없는 이유 : 사용되는 평형 농도가 사실은 농도/1M로 단위를 없앤 값이다.
(활동도)
⊙ 순수한 고체나 액체의 경우 농도의 변화가 없으므로 활동도 = 1 로 한다.
⊙ 평형 상수식의 평형 농도 자리에 순수한 고체나 액체는 "1"을 사용하는 것이므로 식에 나타나지 않는다.
※ 위 화학반응식에서 기체와 고체가 만나서 기체가 되는 반응인데 이렇게 상이 다른 반응에서의 평형을 불균일 평형이
라고 한다.

▣ 금속의 이온화 경향 : 금속물질이 전자를 잘 버리는 정도
K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb
H > Cu > Hg > Ag > Pt > Au
바. 평형상수의 변형


4. 농도평형상수(Kc)와 압력평형상수(Kp)
가. 압력평형상수 (Kp)
▣ 반응물과 생성물이 모두 기체일 때 몰농도를 측정하는 것 보다 기체의 부분압력(atm)을 측정하는 것이 훨씬 간단하다.
⊙ 이 때에도 단위는 생략하며 실제로 평형상수식에 사용되는 기체의 부분압력은 기체의 압력 / 1atm 인 활동도 값이다.

나. 농도평형상수(Kc)와 압력평형상수(Kp) 사이의 변환

※ 일반적인 경우 압력 평형상수는 농도 평형상수에 RT의 델타n승의 곱으로 표현한다.

5. 평형상수의 응용
가. 평형상수를 이용한 평형농도 계산

[농도 계산 절차]
1. 반응표를 만들고 초기 농도를 표시 (농도가 0인 것도 표시)
2. 소모되는 특정 화학종의 양을 x로 두고 반응의 화학양론을 이용하여 다른 반응물과 생성물의 농도 변화량을 x를
사용하여 표시
3. 평형에 있는 각 화학종의 평형농도를 물질의 초기 농도와 x를 사용하여 표시
4. x를 구하기 위해 3에서 구한 평형 농도를 평형 상수식에 대입
5. 계산된 x값을 이용하여 평형에 존재하는 모든 화학종의 농도를 결정

[풀이]
가장 중요한 단계 : 반응표 쓰기 !!

[평형상수를 이용한 평형농도 계산]


[평형상수를 이용한 평형농도 계산]

[풀이]

1. 화학반응과 에너지
▣ 물이 항상 낮은 곳으로 흐르는 것과 같이 자연계의 변화도 에너지가 높은 상태로 부터 낮은 상태, 즉 불안정한 상태로
부터 안정한 상태로 변하려 한다. 그림에서와 같이 A의 물이 산을 넘지 못하므로 B로 흘러가지 못한다. 산을 넘기 위해
서는 A못의 물을 B못으로 퍼 올려야 하는데 이러한 조작을 활성화한다고 하며, 이 때 필요한 에너지를 활성화 에너지
라 한다.

나. 열 화학식

▣ 물질이 화학변화를 일으키는 경우에는 열을 방출하거나 흡수한다.
이 열의 출입을 나타낸 식을 열 화학반응식이라 한다.
① 발열반응 : 발열반응이 클수록 생성되기 쉽고 안정하다.
② 흡열반응 : 흡열반응을 일으키기 위해서는 계속 열을 가해야 하며, 반응이 일어나기 힘들다.
③ 반응 엔탈피 (enthalpy of reaction) : 어떤 물질이 생성되는 동안 그 물질 속에 축적된 에너지를 말한다. 화학반응에서
열효과란 생성물질의 엔탈피와 반응물질의 엔탈피간의 차이이다.
△ H = 생성물질의 엔탈피 - 반응물질의 엔탈피
다. 헤스의 법칙

▣ 화학반응 전 물질의 종류와 상태, 반응 후 물질의 종류와 상태가 결정되면 중간 반응이 어떤 단계로 일어나든 발생하는
열량, 또는 흡수하는 열량의 총합은 같다. 이를 헤스의 법칙이라 한다.

2. 반응속도
가. 반응 속도
▣ 화학반응이 얼마나 빨리 일어나는지를 양적으로 취급할 때 이 빠르기를 반응속도라고 하는데, 반응속도는 온도, 농도,
압력, 촉매, 작용하는 물질의 입자 크기, 빛, 전기, 교반, 효소 등에 따라 달라진다.
<참고> 반응 속도
◈ 단위시간에 감소 또는 증가한 물질의 농도로 표시
금속과 산과의 반응에서 금속은 양으로 (g수), 산은 농도로 나타낸다.
나. 반응속도에 영향을 주는 요소
① 농도 (농도 표시 → [ ]) : 일정한 온도에서 반응물질의 농도(몰/ℓ)가 클수록 반응속도가 커지는데, 반응속도는 반응하는
순간에 반응물질의 농도의 곱에 비례한다.
② 반응속도와 온도 활성화 에너지 : 온도를 상승시키면 반응속도는 증가한다. 일반적으로 수용액의 경우 온도가 10℃
상승하면 반응속도는 약 2배 증가하고, 기체의 경우는 그 이상이다.
<참고> 온도가 상승할 수록 반응속도가 커진다.
열을 가하여 온도를 높게 하면 활성화하는 분자의 수가 증가하기 때문에 반응속도는 그만큼 커진다.
다. 반응속도와 촉매
▣ 촉매는 자신은 변화하지 않고 반응속도만을 증가시키거나 혹은 감소시키는 물질이다.
① 정촉매 : 반응속도를 빠르게 하는 촉매
② 부촉매 : 반응속도를 느리게 하는 촉매
ex : 2H2O2 → 2H2O + O2
<참고> 정촉매 → 활성화 에너지 낮아짐 → 반응속도 증가
부촉매 → 활성화 에너지 높아짐 → 반응속도 감소

<참고> 가역반응
◈ 조건의 변화로 정 · 역 방향으로 진행하는 반응
온도나 농도, 압력 등의 조건 변화에 따라 반응이 정 · 역 어느 방향으로도 진행되는 반응을 가역반응이라 한다.
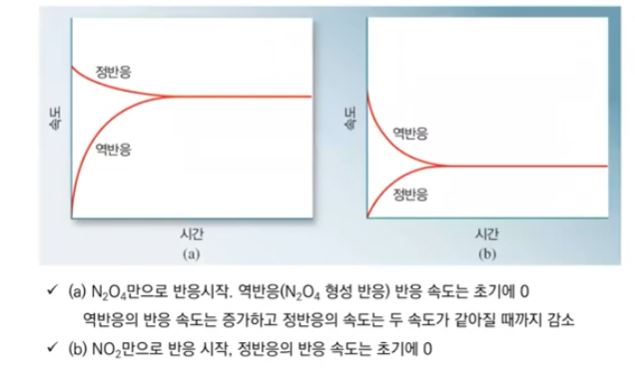
3. 반응속도와 화학평형
▣ 화학반응이 일어나면 반응이 진행됨에 따라 반응물질의 농도 감소가 처음에는 빨리 일어나다가 점점 천천히 일어난다.
어느 시간에 이르러서는 더 이상 감소하지 않게 되는 상태가 되는데 이러한 상태를 정반응과 역반응의 속도가 같은
상태, 즉, 화학평형상태(Chemical equilibrium state)라 한다.
▣ 화학 평형상태의 계를 이루고 있는 생성물과 반응물의 상대적 비율을 결정하기 위해 다음의 일반적 반응식을 생각해
보자.

A와 B를 한 용기에 혼합하고 시간에 따른 A, B의 농도를 측정하여 다음 그림에 나타내었다.

여기서, [A], [B], [C], [D]는 각 물질의 농도를 나타낸다.
이들은 시간 te 에서 변화없이 일정한 값을 보인다.
이 상태를 화학적 평형에 도달했다고 한다.
위 반응에서 C와 D가 생성되는 정반응과 A와 B가 생성되는 역반응의 속도는 각각 다음과 같다.

kf와 kr 은 정반응 속도정수, 역반응 속도 정수를 나타낸다.
정반응과 역반응의 속도가 같은 상태를 화학평형상태라 하고 이를 식으로 나타내면 다음과 같다.

화학평형 상태에서 생성물과 반응물의 농도는 kf 와 kr의 비에 의하여 결정되는 이 값을 평형상수 Kc 라고
한다. 이 관계는 질량작용의 법칙이라고 하며, 이 식을 질량작용식이라 한다.
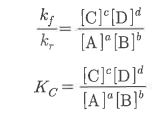
4. 압력으로 나타낸 평형상수
▣ 기체의 농도는 그 물질의 분압으로 나타낼 수 있다.
따라서, 기체의 화학반응에서의 평형상수도 기체의 농도 대신 분압으로 표시할 수 있다.
평형상수와 구분하기 위해 농도에 대한 평형상수를 Kc, 압력에 의한 평형상수를 Kp로 표시한다.
예를 들어 다음 반응의 평형상수는

로 나타낸다.
이 때, PNH3, PN, PH2 는 평형상태를 유지하는 NH3, N2, H2의 분압이다.

여기서, △n 은 생성물의 몰수 - 반응물의 몰수이다.
생성물과 반응물의 몰수가 같으면 △n = 0 으로 Kc 와 Kp는 같은 값을 보인다.
5. 르 샤틀리에 (Le Chatelier)의 원리
▣ 평형계의 조건인 온도와 압력이 변화하면 그 평형계는 어떻게 될까 ?
1884년 Le Chatelier는 평형에 이른 계가 외부에서 교란을 받으면 그 교란을 없애려는 방향으로 반응하여 새로운 평형
상태에 이른다고 설명하였다.
-이를 Le Chatelier의 원리라 한다.
가. 농도 변화
|
㉮ 물질의 농도를 증가시키면, 증가된 물질의 농도를 감소시키는 방향으로 반응이 일어난다.
㉯ 물질의 농도를 감소시키면, 감소된 물질의 농도를 증가시키는 방향으로 반응이 일어난다.
|
다음의 계가 평형을 이루었다고 하자.

반응물이나 생성물의 농도를 조금이라도 변화시키면 이 평형이 깨진다.
예를 들면 H2 농도를 증가시키면 평형이 깨지고 다시 새로운 평형을 이루기 위해 H2의 농도를 감소시키는 방향,
즉 오른쪽으로 반응이 진행된다. H2가 소모됨으로써 HI가 더 생성되어 처음의 평형상태에서의 HI 농도 보다 더 증가하게
된다. 이 때 평형의 위치가 오른쪽으로 이동하였다고 한다.
나. 온도 변화
|
㉮ 온도를 높이면, 온도를 낮추는 방향인 흡열반응으로 평형이 이동한다.
㉯ 온도를 낮추면, 온도를 높이는 방향인 발열반응으로 평형이 이동한다.
|
평형 상수는 온도함수이다.
그러므로 온도가 변하면 평형의 위치도 변하고 평형상수값 자체도 영향을 받는다.
다음의 발열반응 예를 보자.
3H2(g) + N2(g) ↔ 2NH3 (g) + 22.0 kcal
이 계가 평형에 이르렀을 때 온도를 가해 주면 평형은 깨지고 가해진 열의 일부를 소모하는 방향으로 반응이 진행된다.
그러므로 흡열변화를 일으켜 NH3의 분해 반응이 진행된다.
따라서 발열반응의 경우 계의 온도를 높이면 평형의 위치는 왼쪽으로 이동한다.
NH3의 농도는 작아지고 N2와 H2의 농도가 커지므로

Kc 의 값은 식에 따라 작아진다.
다. 압력 변화
|
㉮ 압력을 높이면, 압력이 낮아지는 방향온도를 높이면, 온도를 낮추는 방향인 흡열반응으로 평형이 이동한다.
㉯ 온도를 낮추면, 온도를 높이는 방향인 발열반응으로 평형이 이동한다.
|
일정 온도에서 어떤 계의 외부압력을 높이면 부피는 감소한다. (Boyle의 법칙)
PV = 상수
평형계의 압력이 증가하면 평형은 계의 부피가 작아지는 방향으로 이동하고, 압력이 감소하면 부피가 커지는 방향으로
이동한다.
NH3의 생성반응을 예를 들어 보자.
N2 (g) + 3H2 (g) ⇔ 2NH3 (g)
이 반응은 △n이 -2 이므로 이 평형계에 압력을 증가시키면 반응이 오른쪽으로 진행하여 부피를 감소시킨다.
반응물과 생성물이 모두 고체나 액체일 경우 이들은 비압축성이므로 압력변화가 평형의 위치에 영향을 미치지 않는다.
또한 반응 전후의 기체 몰수에 변화가 없는 경우 즉, △n = 0인 경우도 마찬가지다.
라. 촉매의 영향
▣ 화학평형에서는 정반응과 역반응의 속도가 같다.
여기에 촉매를 가하면 정반응의 속도가 증가하며, 그것과 비례하여 역반응의 속도 또한 증가한다.
따라서 평형상태는 변화가 없다.
촉매는 화학반응의 속도를 증가시키는 작용을 하지만, 화학평형을 이동시킬 수는 없다.

6. 산의 이온화 평형
▣ Arrhenius의 산은 물과 반응하여 수소 이온과 짝염기 이온을 만든다.
이 과정을 산이온화 또는 산해리 (acid ionization or acid dissociation)라 한다.

강한 산이라면 용액에서 완전히 이온화되고 이온의 농도는 산의 처음 농도로 부터 화학양론적인 반응으로
결정된다. 그러나 약한 산은 용액에서 이온의 농도를 구할 때 그 산의 이온화에 대한 평형 상수인 산이온화
(해리) 상수로 결정된다.
약한 1가의 산 HA를 예를 들어 보자.

산의 이온화에 대한 평형상수 (또는 산이온화 상수) Ka 는 아래와 같다.

주어진 온도에서 산 HA의 세기는 Ka가 크면 클수록 산의 세기는 더욱 크고 결국 그것은 산의 이온화 때문
에 평형에서 H+ 이온의 농도가 더 크다는 것을 의미한다.
약한 산의 이온화는 결코 완전할 수 없기 때문에 모든 화학종 (이온화되지 않은 산, 수소이온 및 A- 이온)이
평형에서 존재한다.
7. 용해도 곱
▣ 염의 포화 용액을 만들면 이온과 용기 밑바닥에 있는 녹지 않은 고체 사이에 동적평형이 이루어진다.
염화은의 포화 용액에서 평형을 이루고 있다고 가정하면 다음과 같이 나타낼 수 있다.

이 상태에 대한 평형상수는 다음과 같다.

순수한 고체 농도는 존재하는 고체의 양과는 무관하다. 즉, 고체의 농도는 일정하며 상수 K 속에 포함시킬
수 있다. 따라서, 평형 상수 K에 고체 AgCl의 농도를 곱한 것은 여전히 상수이며, 이것을 Ksp로 표시하고
용해도를 상수라고 부른다.
K [AgCl (s)] = Ksp = [Ag+] [Cl-]
Mg(OH)2와 같이 녹지 않는 고체의 경우에는 해리평형의 계수가 전부 1이 아니다.

용해도 곱 상수는 포화 용액에서의 이온농도들을 해리반응식의 화학양론적 계수 만큼 거듭 제곱한 다음
서로 곱해 준 것과 같다.
포화용액은 이온 곱, 즉 알맞게 제곱승한 이온농도들의 곱이 엄밀하게 Ksp와 같을 때만 존재할 수 있다.
이온곱이 Ksp 보다 작을 때는 이것과 같아질 때까지 더 많은 염이 녹아서 이온농도를 증가시키므로
불포화 용액이다. 반면에 이온곱이 Ksp 보다 클 때는 이온농도를 낮추려고 염의 일부가 침전되며 이를
과포화 용액이라 한다.
#반응속도 #화학평형 #열화학반응식 #헤스의법칙 #촉매 #열량 #가역반응 #정촉매 #부촉매
#르샤틀리에 #평형상수 #용해도곱 #이온화평형
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 배관 이송 설비 (0) | 2024.11.22 |
|---|---|
| 유체역학 기초 이론 (단위와 차원) (4) | 2024.11.22 |
| 유기화합물 - 방향족 및 지방족 화합물 (0) | 2024.11.20 |
| 유기화합물 - 알칸, 알켄, 알킨 (10) | 2024.11.19 |
| 유기화합물 - 1 (4) | 2024.11.18 |