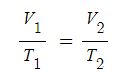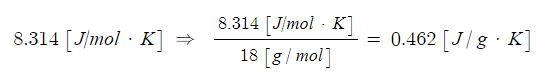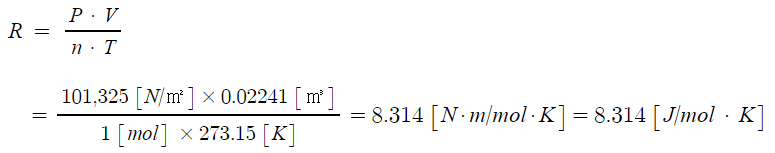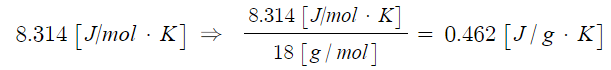1. 보일의 법칙
▣ 온도가 일정할 때 압력과 부피는 반비례한다.
PV = K (일정), PV = P'V'
※ 풍선을 강하게 누르면 (압력을 증가시키면) 부피는 감소한다.
2. 샤를의 법칙
▣ 압력이 일정할 때 절대온도와 부피는 비례한다.

※ 겨울철 보다 여름철에 타이어 부피가 팽창한다.
[개념잡기] TNT의 1kg이 폭발할 경우 표준상태에서 기체의 부피는 830ℓ 이다. 1기압 2.217 ℃ 일 경우 기체의 부피는
고체상태일 때 TNT의 몇 배인지 구하시오.
<문제 풀이>
▣ 샤를의 법칙
⊙ 온도가 일정할 때 절대온도와 부피는 비례한다. T는 절대온도(K)를 대입한다.
1기압에서 0℃ 830ℓ 일 때, 2,217℃ 에서 기체의 부피

3. 보일-샤를의 법칙
▣ 보일의 법칙과 샤를의 법칙을 합친 것

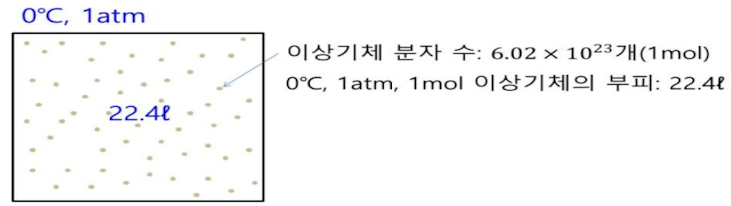
▣ 기체 1몰은 0℃, 1기압에서 22.4 ℓ 의 부피를 가지므로 일정한 값을 가진다.

▣ 기체의 몰수에 비례하므로 다음과 같이 이상기체상태방정식이 도출된다.
PV = nRT
여기서, P : 압력, V : 부피, n : 기체몰수, R : 기체상수, T : 절대온도
※ 이상기체상태방정식이란 이상기체가 압력, 온도 등의 변수에 의해 변하는 상태를 일반적인 식으로 나타낸 것이다.

여기서, P : 압력, V : 부피, W : 기체무게, M : 기체분자량, R : 기체상수, T : 절대온도
|
기호
|
의미
|
단위
|
|
|
P
|
압력
|
atm
|
|
|
V
|
부피
|
ℓ
|
㎥
|
|
w
|
질량
|
g
|
kg
|
|
M
|
분자량
|
g/mol
|
kg/kmol
|
|
R
|
기체상수
|
0.082atm·ℓ/mol·K
|
0.082atm·㎥/kmol·K
|
|
T
|
절대온도
|
K = ℃ + 273
|
|
4. 화학반응 없는 유형
상태변화 (고체 → 액체 → 기체)만 일어나는 경우이다.

5. 화학반응이 있는 유형 ★★★
▣ 문제에서 질량 등 조건을 제시한 물질과 구해야 하는 물질이 다르므로 몰수 비를 한번 더 곱해준다.

※ 밀도를 구하라고 하면

[개념잡기] 나이트로글리세린 500g이 부피 320 ㎖인 용기 내부에서 분해 폭발 후 압력 (atm)은 얼마인지 구하시오.
(단, 폭발온도는 1,000℃ 이며 이상기체로 간주한다.)
<문제풀이>
이상기체 상태방정식을 이용한다.
나이트로글리세린의 분해 화학식은 다음과 같다.
4C3H5(ONO2)3 → 12CO2 + 10H2O + 6N2 + O2

⊙ P(압력) = 1atm
⊙ M(분자량) = C3H5(ONO2)3 = 12×3+1×5+16×3+14×3+16×2×3=227g/mol
⊙ w(질량) = 500g
⊙ R (기체상수) = 0.082 atm·ℓ/mol · K
⊙ T (절대온도) = 1,000℃ + 273 = 1,273 K

1기압에서 1,666.96 ℓ 이므로 0.32 ℓ에서 압력을 구한다.
PV = P1V1
1atm × 1,666.96 ℓ = x atm × 0.32ℓ
x = 5,209.25 atm
6. 생성물의 질량 구하기 ★★★
▣ 발생하는 물질의 g 또는 ㎏을 구할 때 아래 공식을 사용한다.

[개념잡기] 비중이 0.8인 메탄올 10ℓ가 완전연소할 때 소요되는 이론 산소량(㎏)과 생성되는 이산화탄소의 부피 (㎥)를
구하시오. (단, 25℃, 1기압)
<문제풀이>
▣ 이상기체 상태방정식을 이용하여 푼다.
⊙ 메탄올의 연소식을 먼저 구성한다.
2CH3OH + 3O2 → 2CO2 + 4H2O

※ 질량 구하기 - 표준상태 기준

▣ 생성되는 기체의 부피
⊙ P(압력) = 1atm
⊙ M(분자량) = CH3OH=12+1×3+16+1=32 kg/kmol
⊙ w(질량) = 0.8 ㎏/ℓ × 10 ℓ = 8 ㎏
⊙ R(기체상수) = 0.082 atm · ㎥ / kmol · K
⊙ T(절대온도) = 25 ℃ + 273 = 296 K

#이상기체 #상태방정식 #보일 #샤를 #온도 #압력 #표준대기압 #절대온도 #기체상수
'위험물 기능장 실기' 카테고리의 다른 글
| 주기율표와 원소 (0) | 2025.02.28 |
|---|---|
| 화학반응식 (0) | 2025.02.27 |
| 연소와 소화 (0) | 2025.02.10 |
| 위험물의 종류와 소화설비 (4) | 2025.02.09 |
| 위험물의 종류와 성질 (제1,2류 위험물) (2) | 2025.02.08 |