
1. 원자량
1~20번 원자의 원자량을 구하는 방법은 다음과 같다.
⊙ 원자번호가 홀수일 때 : 원자번호 × 2 + 1
⊙ 원자번호가 짝수일 때 : 원자번호 × 2
이 방법이 맞지 않는 예외 원소가 5가지이며 원자량은 다음과 같다.
|
H (수소)
|
Be (베릴륨)
|
N (질소)
|
Cl (염소)
|
Ar (아르곤)
|
|
1
|
9
|
14
|
35.5
|
40
|
▣ 원자량은 탄소 12를 기준으로 양을 비교한 값이므로 단위가 없다. 단, 물질 1mol 이 있을 때의 g수를 말한다.
※ 산소의 원자량은 16이다. O2의 1 mol 이 있을 때 32g 이 된다.
<참고> 탄소(C)는 6번 원소이다.
원자번호가 짝수 이므로 원자량을 구하기 위해서
원자번호 × 2를 하면 6 × 2 = 12이다.
나트륨(Na)은 11번 원소이다.
원자번호가 홀수이므로 원자량을 구하기 위해
원자번호 × 2 + 1 을 하면 11 × 2 + 1 = 23이다.
수헬리베 붕탄질 산풀네 나마알 규인황염 아칼칼
|
H
수소
|
|
He
헬륨
|
|||||
|
Li
리튬
|
Be
베릴륨
|
B
붕소
|
C
탄소
|
N
질소
|
O
산소
|
F
플루오린
|
Ne
네온
|
|
Na
나트륨
|
Mg
마그네슘
|
Al
알루미늄
|
Si
규소
|
P
인
|
S
황
|
Cl
염소
|
Ar
아르곤
|
|
K
칼륨
|
Ca
칼슘
|
|
|
||||
※ 평균 원자량 : 평균 원자량 = Σ 원자량 × 비율
2. 몰 (mol)
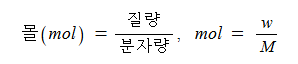
3. 증기비중
▣ 공기의 밀도 (29g/22.4ℓ)를 기준으로 한 해당 기체와의 밀도의 비 (단위없음)

[개념잡기]
▣ 어떤 화합물의 질량을 분석한 결과 나트륨 58.9%, 산소 41.03%였다. 이 화합물의
실험식과 분자식을 구하시오. (단, 화합물의 분자량은 78(g/mol)이다)

4. 농도
▣ 몰 농도 (M) : 용액 1ℓ 속에 녹아 있는 용질의 몰 수
▣ 노르말 농도 (N) : 용액 1ℓ에 녹아 있는 용질의 g 당량수
▣ 몰랄 농도 (m) : 용매 1 ㎏ 속에 녹아 있는 용질의 몰 수

<참고>
▣ 노르말 농도 (N)
⊙ 당량(n) × 몰 농도 (M)
▣ 산의 당량
⊙ 이온화되어 수소이온 (H+)을 내는 개수
ex : HCl : 1당량
H2SO4 : 2당량
5. 용해도
가. 고체의 용해도
▣ 용매 100g 에 용해되는 용질의 g수

▣ 온도가 증가하면 더 잘 녹으므로 용해도가 증가한다.
▣ 70℃에서 용해도가 50이라면, 용매 100g 에 용질 50g이 녹은 것이므로
용액의 양은 150g으로 보아야 한다.
#용해도 #몰농도 #몰랄농도 #노르말농도 #주기율 #원자량 #원소 #원자번호
'위험물 기능장 실기' 카테고리의 다른 글
| 위험물기능장 실기 제48회 2010년 (2) | 2025.03.07 |
|---|---|
| 위험물기능장 실기 제47회 2010년 (2) | 2025.03.03 |
| 화학반응식 (0) | 2025.02.27 |
| 이상기체 상태 방정식 (0) | 2025.02.23 |
| 연소와 소화 (0) | 2025.02.10 |
