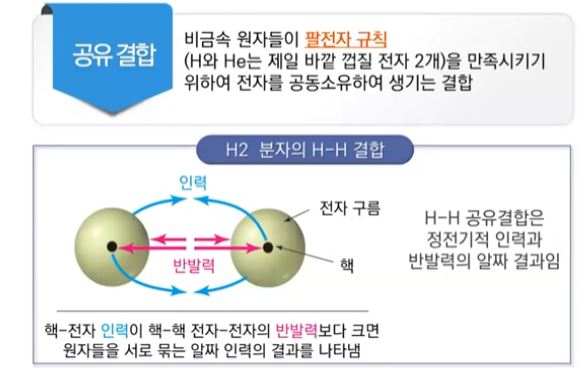
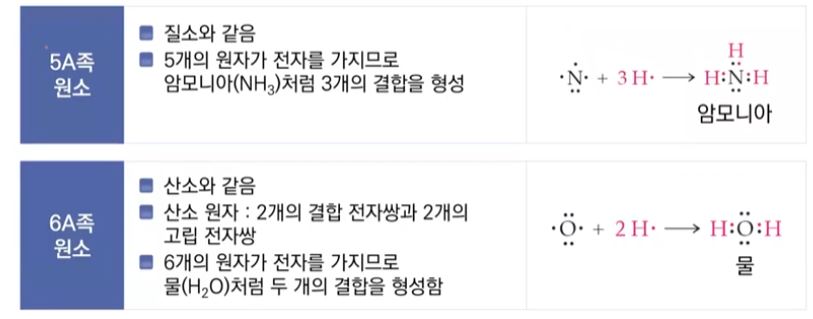
1. 금속과 그 화합물
가. 알칼리 금속 (출제빈도 높음) ★★★
|
▣ 원자가 : +1
▣ 전자 1개 잃고 +1가 이온이 되기 쉽다.
▣ M → M+ + e-
|

① 결합력이 약하고 연하며 가벼운 은백색 광택이 나는 밀도가 작은 금속이다.
밀도가 매우 작아 물에 뜰 정도로 가볍다.
② 반응성이 매우 크다.
<참고> 알칼리 금속은 화학반응이 가장 활발한 금속이다.
화학반응은 원자번호가 클수록 활발하다.
⊙ 55Cs > 37Rb > 19K > 11Na > 3Li

③ 공기 중에서 쉽게 산화된다. 알칼리 금속을 공기 중에 노출시키면 순식간에 산화되어 색이 변한다.
ex : 4 Na + O2 → 2 NaO
④ 알칼리금속은 찬물과 격렬하게 반응함은 물론 공기 중의 수증기와도 반응하여 수소 기체를 발생시키며 수산화물을
만들고, 많은 열을 낸다. 따라서, 알칼리 금속은 반드시 석유나 유동성 파라핀 속에 보관하여 공기중의 산소와 수분
으로 부터 격리시켜야 한다.
ex : 2Na + 2H2O → 2 NaOH + H2
⑤ 알칼리금속은 불꽃 반응을 한다. 알칼리 금속은 공기 중에서 연소하면서 특유의 빛을 낸다.
이 반응을 이용하여 알칼리 금속을 구별할 수 있다.
Li (빨강), Na (노랑), K (보라), Rb (빨강), Cs (청자)
⑥ 산화물의 수용액은 모두 강한 염기성을 나타낸다.
M2O + 2H2O → 2MOH + H2
MOH → M+ + OH-
ex : 2 Na (s) + H2O (l) → 2 NaOH (s)
NaOH → Na+ + OH-
⑦ 끓는 점과 녹는 점이 낮다.
원자번호가 클수록 원자 반경이 급속히 커져 원자 간의 인력이 작아지기 때문에
녹는점과 끓는 점이 낮아진다.
Li > Na > K > Rb > Cs
나. 알칼리토 금속
① 알칼리토 금속의 일반적 성질
▣ 알칼리토 금속은 주기율표 Ⅱ족에 속하는 원소들이다.
Be, Mg, Ca, Sr, Ba, Ra 등 6개 원소가 여기에 속한다.
이들 원소들은 반응성이 강하며 최외각에 2개의 전자를 갖고 있어 2가의 양이온이 된다.
㉠ 알칼리 금속 원소와 흡사하며 은회백색의 금속으로 가볍고 연하다.
㉡ 알칼리금속처럼 활발하지 않지만 공기 중에서 산화되며 물과 반응하여 수소를 만든다.
㉢ 금속의 염은 무색이고, 염화물, 질산염은 모두 물에 잘 녹는다.
㉣ Ca, Sr, Ba의 탄산염, 황산염은 물에 녹기 어렵다.
㉤ Be, Mg 을 제외한 금속은 불꽃반응으로 고유한 색을 나타낸다.
<참고> 양쪽성 산화물과 알칼리 반응
Al2O3 + 2NaOH → 2NaAlO2 + H2O
산화알루미늄 알루민산나트륨

㉥ 알칼리 금속과 같이 원자번호가 증가할 수록 활성이 커진다.
Be < Mg < Ca < Sr < Ba
다. 단물과 센물
① 단물(연수) : 물 속에 Ca2+, Mg2+ 이 비교적 적게 녹아 있어 비누가 잘 풀리는 물
ex : 수돗물
② 센물(경수) : 물 속에 Ca2+, Mg2+이 많이 녹아 있어 비누가 잘 풀리지 않는 물
ex : 우물물, 지하수
③ 비누와 센물의 반응 : 물 속의 Mg2+, Ca2+ 이 비눗물의 음이온 (RCOO-)과 결합하여 물에 녹지 않는 염을 수면 위에
거품형태로 만든다.
ex : 2RCOONa + Ca(HCO3)2 → (RCOO)2Ca ↓ + 2NaHCO3

2. 비금속 원소
가. 비활성 기체
① 기본 성질
㉠ 비활성 기체는 다른 원소와 화합하지 않고 원자 구조상 전자배열이 극히 안정하고, 화합물을 거의 만들지 않는
단원자 분자이다.
㉡ 헬륨 (He)을 제외하고는 원자가 전자가 모두 8개로서 다른 원자도 이와 같은 전자배열을 취하여 안정한 화합물을
만든다.
㉢ 비활성 기체는 방전할 때 특유의 색을 내므로 야간 광고용에 이용된다.
㉣ 비활성 기체라 할지라도 원자번호가 큰 것은 여러가지 화합물로 발견되었다.
② 비활성 기체의 화합물
㉠ 안정한 전자배치를 하고 있기 때문에 화합물을 형성하지 않으며, 상온에서 단원자 분자로 안정하게 존재할 수 있다.
㉡ 몇 가지 인공적으로 합성한 화합물이 존재하기는 하나 매우 불안정하여 쉽게 분해된다.
ex : XeF6, XeF4, XeF2, XePtF6
나. 할로겐 원소
① 기본 성질
◈ 원자가 전자가 7개, 원자가 -1
◈ 전자 1개를 받아 -1가 이온이 되기 쉽다.
㉠ 수소와 금속에 대해서 화합력(산화력)이 매우 강하다.
㉡ 최외각의 전자수가 7개이며, 한 개의 전자를 밖에서 얻음으로써 안정한 전자배열을 갖고자 하기 때문에 -1 가의
이온이 된다.
㉢ 수소화합물은 무색, 발연성의 자극성 기체로서 물에 쉽게 녹으며 강한 산성 반응을 나타낸다.
㉣ 금속 화합물은 불소(F)를 제외한 다른 할로겐 원소의 은염, 제1 수은연염(鉛鹽) 등을 제외하고는 다 물에 녹는다.
◈ 물에 녹지 않는 염 : AgCl↓, Hg2Cl2 ↓, PbCl2↓, Cu2Cl2 ↓ 등
② 할로겐 원소의 반응성
㉠ 알칼리 금속과 직접 반응하여 이온결합 물질을 만든다.
2Na (s) + Cl2 (g) → 2NaCl (s)
㉡ 할로겐화수소의 결합력 세기
HF > HCl > HBr > HI
㉢ 할로겐화수소산의 산의 세기 비교
⊙ 할로겐화수소는 모두 강산이나 HF는 분자 간의 인력이 강하여 약산이다.
HF < HCl < HBr < HI
⊙ 강산이란 수용액에서 H+이 많이 생기는 산이다.
따라서 결합력이 약할 수록 이온화가 잘 되어 강한 산에 속한다.

3. 방사성 원소
가. 방사선의 종류와 작용
① 방사선 핵 충돌 반응
㉠ 방사선 붕괴 : 핵이 자연적으로 붕괴되어 방사선 (α, β, γ)을 발생
㉡ 핵충돌 반응 : 핵입자가 충분한 에너지를 가지고 충돌할 때 새로운 핵 생성
<참고> 방사선이란 무엇인가 ?

◈ 원자핵은 양성자와 중성자로 이루어져 있다. 양성자와 중성자가 결합하여 원자핵을 형성할 때는 양성자와 중성자의
비율에 의해 안정한 원자핵이 만들어지기도 하고 불안정한 원자핵이 만들어지기도 한다.
불안정한 원자핵은 양성자 두 개와 중성자 두 개로 이루어진 알파(α)입자, 전자, 전자기파인 감마(γ)선, X선, 중성자 등
을 내놓고 안정한 원자핵으로 바뀐다. 어떤 원자핵이 다른 원자핵으로 바뀔 때 내놓는 알파선, 전자, 감마선, X선, 중성
자를 방사선이라고 한다. 방사선은 원자핵 주위를 돌고 있는 전자가 내놓는 전자기파보다 에너지가 크기 때문에 훨씬
더 위험하다.
② α 선 : α선에 전기장을 작용하면 (-)극 쪽으로 구부러진다. 이를 통해 α선이 (+)전기를 가진 입자의 흐름이란 것을 알게
되었다. 이는 헬륨의 핵 (He2+)으로, (+)전하의 질량수가 4이다. 투과력은 가장 약하다.
③ β선 : 전기장을 가하면 (+)극 쪽으로 구부러지므로 β선은 (-) 전기를 띤 입자의 흐름, 전자의 흐름으로 보고 있다.
투과력은 α선 보다 크고, β선 보다 작다.
④ γ선 : 전기장에 대하여 영향을 받지 않고 곧게 나아가므로 그 자신은 전기를 띤 알맹이가 아니며, 광선이나 X선과 같은
일종의 전자파이다.
γ선의 파장은 X선 보다 더 짧으며 X선 보다 투과력이 더 크다.

⑤ 방사선의 작용
㉠ 투과력이 크며, 사진 건판을 감광한다.
㉡ 공기를 대전시킨다.
㉢ 물질에 에너지를 줌으로써 형광을 내게 한다.
㉣ 라듐(Ra)의 방사선은 위암의 치료에 이용된다.

⑥ 핵방정식 : α 입자의 방출 (He 핵을 잃음)에 의한 U의 방사성 붕괴의 핵방정식은 다음과 같다.

나. 원소의 붕괴
▣ 방사성 원소는 단체이든 화합물의 상태이든 온도 · 압력에 관계없이 방사선을 내고 다른 원소로 된다.
이와같은 현상을 원소의 붕괴라고 한다.
▣ 불안정한 원자핵을 가지고 있는 원소가 방사선을 내놓고 다른 원소로 변해가는 것을 방사성 붕괴라고 한다. 불안정의
정도에 따라 방사성 붕괴에 걸리는 시간이 다르다. 어떤 양의 방사성 원소가 붕괴하여 반이 남는 데 걸리는 시간을
반감기라고 한다. 반감기가 짧을수록 더 불안정한 원자핵이다.
▣ 이런 방사성 원소들이 붕괴할 때는 항상 방사선이 나온다. 방사선은 큰 에너지를 가지고 있어 인체에 큰 영향을 줄 수
있다. 방사선의 세기를 측정하는 가장 오래된 방법은 1초에 몇 번의 방사성 붕괴가 일어나느냐를 측정하는 것이다.
1초에 한 번의 방사성 붕괴가 일어나는 경우, 즉 1초에 하나의 방사선이 일어나는 방사능의 세기를 1베크릴(Bq)이라고
한다. 베크렐은 너무 작은 값이어서 실제로는3.7×1010Bq를 나타내는 큐리(Ci)라는 단위를 많이 사용한다.
▣ 방사선이 위험한 것은 방사선이 우리 몸의 원자나 분자를 전리시킨다는 것이다. 방사선의 에너지와 전리 현상은 우리
몸 세포의 DNA를 파괴하여 암을 유발하고, 전리된 수소나 수산화이온은 다른 물질과 화합물을 만들어 각종 질병을
유발할 수 있다.

따라서 주기율표에서는 두 칸 앞자리의 원소로 된다.

◈ α 붕괴에 의하여 원자번호는 2, 질량수는 4 감소된다.
② β붕괴 : 어떤 원소에서 β붕괴가 일어나면 질량수는 변동없고, 원자번호가 하나 증가하여 새로운 원소로 된다.
따라서 주기율표에서 한 칸 뒷자리의 원소로 된다.

◈ β붕괴에 의하여 원자번호는 1 증가하고, 질량수는 변동없다.
③ γ선 : γ선은 방출되어도 질량수나 원자번호는 변하지 않는다.

|
구 분
|
원자번호
|
질량수
|
|
α 붕괴
|
-2
|
- 4
|
|
β 붕괴
|
+ 1
|
변화없음
|
|
γ 붕괴
|
변화없음
|
변화없음
|
다. 핵반응
▣ 원자핵이 자연 붕괴되거나 가속입자로 원자핵이 붕괴되는 현상을 핵반응이라 하며, 이 반응을 화학식으로 표시한 식을
핵반응식이라 한다. 이 때 왼쪽과 오른쪽의 질량수의 총합과 원자번호의 총합은 반드시 같아야 한다.

▣ 원자핵의 종류가 변하는 반응 모두 부르는 개념으로, 서로 다른 두 핵이 몇 개의 양성자와 중성자를 교환하여 새로운
핵이 되는 반응, 무거운 핵 한 개가 두 개의 가벼운 원자핵으로 쪼개지는 핵분열 (nuclear fission), 두 개의 가벼운 핵이
무거운 핵 한 개로 뭉쳐지는 핵융합(nuclear fusion) 등을 포함한다.
이런 과정에 수반되는 에너지는 핵력에 의한 것으로 동일한 질량의 원자나 분자가 만들어낼 수 있는 화학적 에너지에
비해 수백만배의 크기를 가진다.

[풀이] 반응 전후의 핵의 질량수의 총합과 양성자수의 총합은 같으므로
질량수 = (9 + 4) - 1 = 12
양성자수 = (4 + 2) - 0 = 6
라. 반감기
▣ 방사성 핵의 반감기는 핵의 반이 붕괴하는데 걸리는 시간으로 정의한다.
즉, A → 생성물이며, 반감기는 A의 반이 반응하는데 걸리는 시간이다.
붕괴되는 속도는 붕괴되기 전의 원소의 양 (원자수, 방사능 세기)이 반으로 감소하기 까지에 걸리는
시간으로 나타내는데, 이 시간을 반감기라고 한다.

여기서, M : 최후의 질량, m : 최초의 질량, T : 반감기, t : 경과시간
[예제] 어떤 방사능 물질의 반감기가 10년이라면 10g의 물질이 20년 후에는 몇 g이 남는가 ?

마. 원자에너지
▣ 아인슈타인의 일반 상대성 원리에 의하면 물질의 질량과 에너지는 서로 바뀔 수 있으며
E = mc2
여기서, E : 생성되는 에너지 (erg)
m : 질량 결손 (원자핵이 파괴될 때 없어진 질량)
C : 광속도 (㎝/s) = 3 × 1010 ㎝/s
와 같은 관계가 성립한다.
#무기화합물 #알칼리금속 #산화물 #경수 #연수 #알칼리토금속 #할로겐 #불활성기체 #방사성
#핵반응 #반감기 #양성자 #중성자
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 유기화합물 - 알칸, 알켄, 알킨 (10) | 2024.11.19 |
|---|---|
| 유기화합물 - 1 (4) | 2024.11.18 |
| 산화 · 환원 반응 (화학반응) (6) | 2024.11.17 |
| 용액과 용해도 (0) | 2024.11.13 |
| 산과 염기 (2) | 2024.11.12 |