【 목 차 】
1. 원자량
2. 몰 (mole)
3. 몰질량 (molar mass)
4. 화학반응의 양적 관계
5. 화학반응식 완결
6. 한계 반응물
1. 원자량
가. 원자량 (Atomic mass)
▣ 동위 원소의 존재비를 고려한 원자의 평균 질량
나. 원자량 단위 (Atomic mass unit)
▣ 질량수 12인 탄소원자 (12C) 질량의 12분의 1
[예시]
▣ 염소(Cl) 원자의 원자량을 구하는 방법
⊙ 염소 원자는 질량수가 35인 35Cl이 자연계에 75.78[%] 존재하고 질량수가 37인
37Cl 이 24.22 [%] 존재한다.
※ 0.7578 × 35 amu + 0.2422 × 37 amu = 35.5 [amu] 따라서 염소의 원자량은 35.5 이다.
[예] 탄소를 예를 들면 탄소는 3종류가 있다.

위의 내용은 원자의 질량비를 나타낸 것이다.
그런데 원자량은 그 원자의 구성비를 나타 내므로
탄소의 원자량은 다음과 같이 구할 수 있다.

▣ 모든 원자의 질량은 탄소를 기준으로 하고 탄소중에서 원자번호 12를 기준으로 한다.
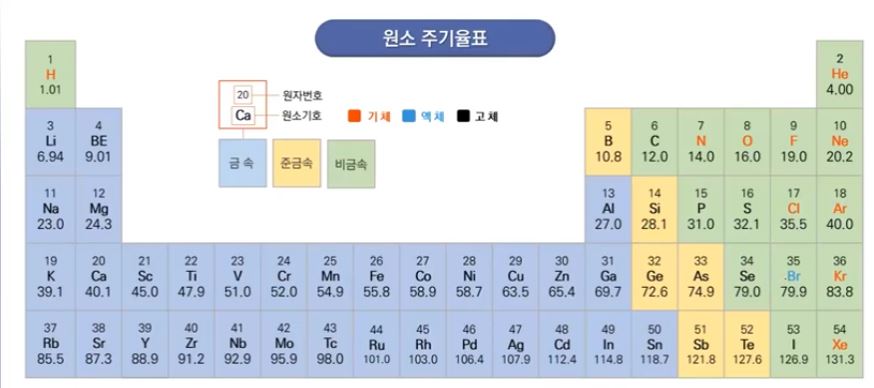
다. 중요한 원소들의 원자량
2. 몰 (mole)
가. 새로운 단위의 필요성
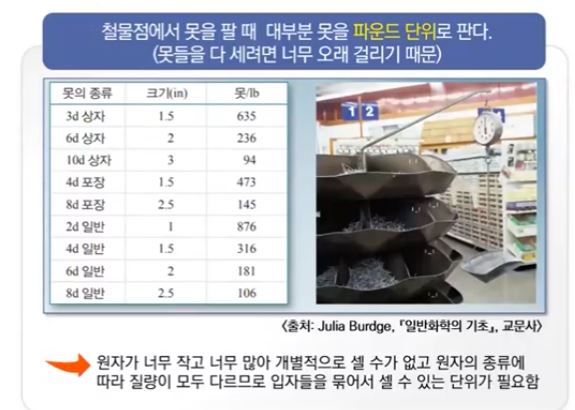
▣ 원자는 눈에 보이지도 않을 정도로 작아서 원자 종류에 따른 질량을 다루기가
힘들어 별도의 단위 설정이 필요하다.
▣ 화학에서 가장 많이 사용하는 단위가 몰(mole)이다.
원자의 질량 단위 몰(mole)은 화학자 아보가드로가 설정했다.
나. 몰(mole)의 정의

※ 보통 우리가 살고 있는 상온(25[℃]), 1기압에서 원자 1[mol]이면 부피가
어느 정도 되냐면 기체 분자로 보았을 때 농구공 3개 크기 정도로 보면 된다.
※ 왜 1[mol]의 숫자 6.02 × 1023 숫자는 어떻게 나왔을까 ?
다. 몰(mole)의 의미

※ 신기하게도 탄소원자 12 [g]을 측정하면 탄소원자 6.022 × 1023 개가 나온다.
따라서 원자를 그램[g] 단위로 측정할 수 있게 되었다.
즉, 화학에서 원자를 [g] 수를 알면 그 속에 들어 있는 원자 개수를 알게 되었다.
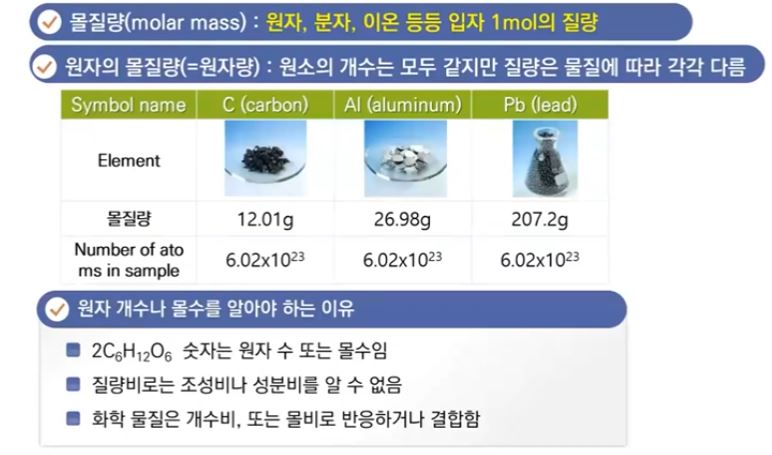
3. 몰 질량 (molar mass)
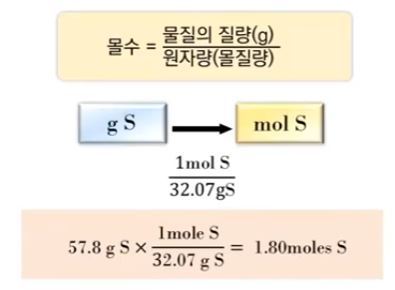
예제1) 57.8 [g] 황의 몰수를 계산하시오. (황의 몰질량 32.07[g/mol])
⊙ 57.8 [g] ÷ 32.07 [g/mol] = 1.08 [moles]
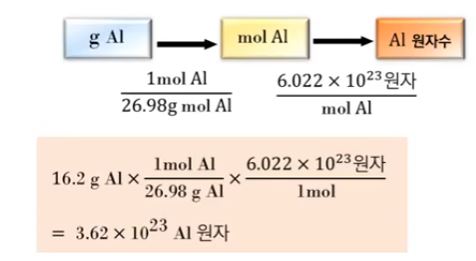
예제2) 16.2 [g] 질량의 알루미늄 캔 속에 들어 있는 알루미늄 원자 개수를 구하시오.
(알루미늄의 몰질량 26.98 [g/mol])
16.2 [g] ÷ 26.98 [g/mol] × 6.02 × 1023 [개]
[몰질량은 분자량에도 해당된다]
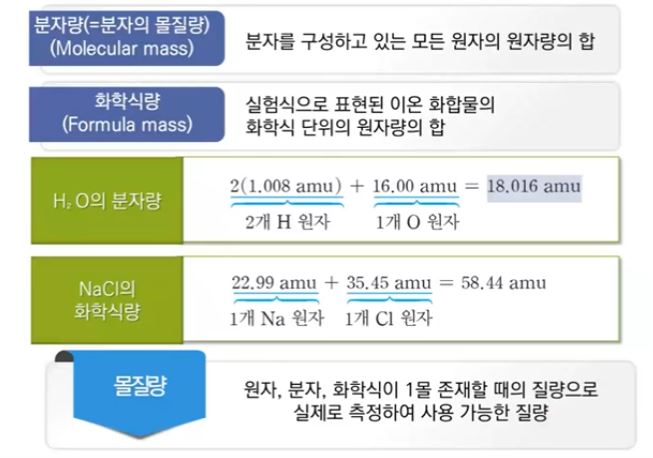
▣ Nacl 의 경우에는 Na+ 하나에 Cl- 하나가 연속하여 결합을 하는데 이런 경우 각각의
알갱이를 구분할 수가 없다. 이런 화합물을 이온 결합 물질이라고 한다.

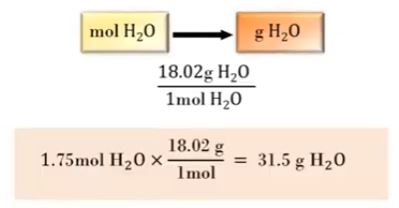
예제 3) 물 1.75[mol]에 해당하는 질량을 그램 단위로 계산하시오 (물의 몰질량 18.02 [g/mol])
1.75 × 18.02 = 31.5 [g, H2O]
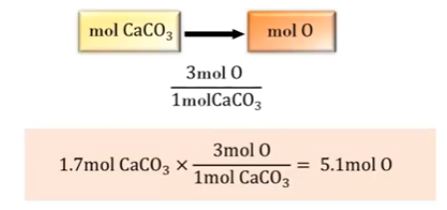
예제 4) 1.7 [mol] CaCO3 속에 있는 O의 몰수를 결정하시오.
1.7 × 3 = 5.1 [mol, O]
4. 화학반응의 양적관계 (화학양론, Stoichiometry)
가. 화학 반응이란 ?

▣ 화학반응이란 물질이 다른 물질과의 상호 작용을 반응이라 하는데 이 반응을 통해
화학적 성질이 다른 새로운 물질이 만들어 진다.
▣ 이 화학반응 전과 후에 존재하는 원자의 종류의 변화는 없다. 원자들이 재배열하여
새로운 물질이 되지만 원자가 생성하거나 파괴되지 않는다.
※ 원자가 생성되거나 파괴되는 반응은 화학반응이라 부르지 않고 핵반응이라 부른다.
▣ 물질의 반응물과 생성물의 관계


나. 화학반응의 표기

▣ 위 반응식은 염산에서 나오는 기체 염화수소가 만나서 염화 암모늄이 되는 반응식이다.
▣ 화학에서 화살표는 반응이 진행된다는 것을 의미한다.
▣ 항상 반응물은 왼쪽에 , 생성물은 오른쪽에 쓴다.
▣ 반응물과 생성물은 화학식으로 표기를 하고 기체, 액체, 고체 등 상태를 함께 표시한다.
▣ 반응식 화살표 위의 △는 가열을 하여 반응하도록 하는 것을 의미한다.
다. 화학양론

[예제] 수소(H2)와 질소 (N2)가 결합하여 암모니아(NH3)를 생성하는 화학반응식을 완결 하시오.
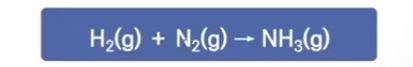
[풀이]

[응용] 만약 N2 3[mol]과 과량의 H2가 있다면 NH3 분자 몇 [mol]이 생성될까 ?
<풀이> N2 가 3몰이 있는데 암모니아 분자에는 원자 N으로 존재하므로
N은 2 × 3 = 6 몰 만큼 반응하게 된다. (H2는 무한대 있으므로)
따라서 NH3는 6몰이 생긴다.
5. 화학반응식 완결
▣ 휴대용 가스레인지에 사용되는 부테인(부탄)가스의 연소 반응을 완결하시오.

▣ 메테인(CH4)의 연소반응은 다음과 같다.
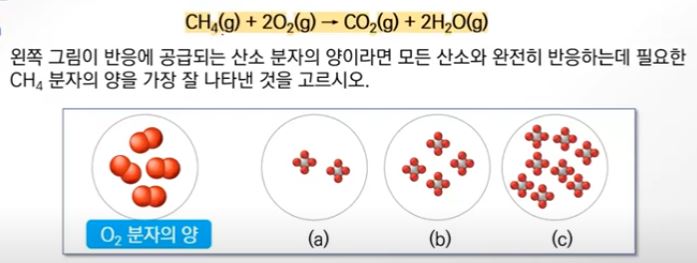
[풀이]

[예제] 뷰티르산(C4H8O2)은 유지방에서 발견되는 화합물중 하나이다. 1869년에 썩은
냄새가 나는 버터에서 처음 분리되었으며 잠재적인 항암제로 최근 많은 관심을 받았다.
뷰티르산이 체내에서 대사될 때의 균형 잡힌 반응식을 쓰시오.
(대사 반응은 연소와 전체 과정이 동일하며, 산소와 반응하여 이산화탄소와 물이 생성
되는 반응이다)
C4 H8 O2 + O2 ⇒ CO2 + H2O
4 C 1
8 H 2
4 O 3
C4 H8 O2 (g) + 5 O2 (g) ⇒ 4 CO2 (g) + 4 H2O (g)
4 C 4
8 H 8
12 O 12

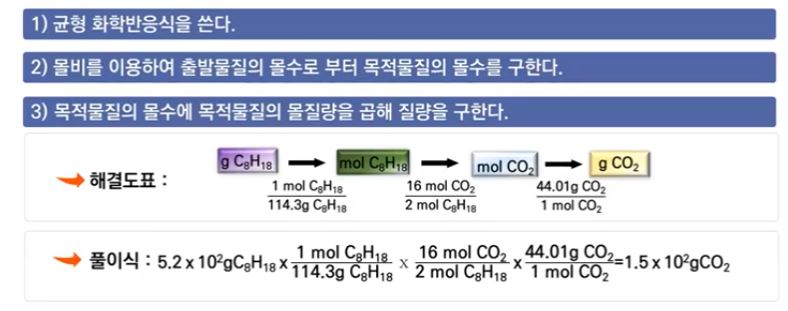
[예제] 5.2 × 102 [g] 의 순수한 옥테인(옥탄 C8H18)의 연소로 방출되는 CO2의 질량을 구하시오.
6. 한계반응물
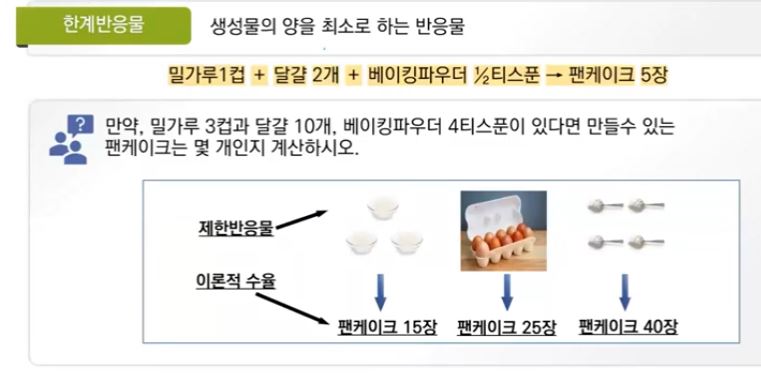
▣ 화학반응에서 반응물 중에서 어느 하나가 부족한 경우 그 반응물의 몰수 내에서 반응을
하게 되므로 그 반응물을 한계반응물이라고 한다.
※ 위 그림에서 밀가루는 만들 수 있는 팬케이크의 수를 제한한다. 만약 이것이 화학반응
이라면 밀가루는 화학반응에서 생성물의 양을 제일 적게 만드는 반응물인 한계반응물 (limiting reactant)가 된다.
[예제]
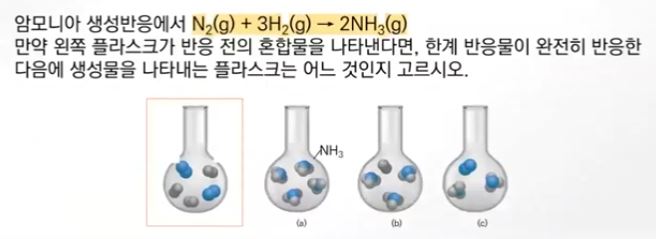
[풀이]

'소방설비기사 (전기) > 소방원론' 카테고리의 다른 글
| 공유결합과 결합의 극성 (기초화학) (0) | 2022.11.25 |
|---|---|
| 이온 결합 물질과 금속 결합 물질 (0) | 2022.11.24 |
| 주기율표와 원소의 주기적 성질 (2) | 2022.11.22 |
| 원자의 구조와 원자 모형 (2) | 2022.11.22 |
| 열 화학 반응식과 엔탈피 (2) | 2022.11.21 |
