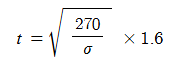1. 분자량 227g/mol, 융점 811℃, 순수한 것은 무색 결정 또는 담황색의 결정, 직사광선에 의해 다갈색으로 변하며, 톨루엔과 질산
을 일정 비율로 황산 촉매하에 반응시켜면 얻어지는 물질이다. 다음 물음에 답하시오.
① 유별
② 품명
[풀이] 트리나이트로톨루엔은 제5류 휘험물로서 나이트로화합물에 속한다. 몇 가지 이성질체가 있므며 2, 4, 6- 트리나이트로톨루엔
이 가장 폭발력이 강하다. 비중 1.66, 융점 84℃, 비점 280℃, 분자량 227, 발화온도 약 300℃ 이다. 1몰의 톨루엔과 3몰의
질산을 황산의 촉매하에 반응시키면 나이트로화에 의해 T.N.T가 만들어 진다.

[정답] ① 제5류 위험물
② 나이트로화합물
2. 다음 2류 위험물의 저장 및 취급 기준에 대한 설명이다. 괄호 안을 알맞게 채우시오.
제2류 위험물은 ( ① )와 접촉 · 혼합이나 불티 · 불꽃 · 고온체와의 접근 또는 과열을 피하는 한편, 철분 · 금속분 · 마그네슘 및
이를 함유한 것에 있어서는 ( ② )이나 ( ③ ) 과의 접촉을 피하고 인화성 고체에 있어서는 함부로 ( ④ )를 발생시키지 아니하여야
한다.
[정답] ① 산화제 ② 물 ③ 산 ④ 증기
3. 제5류 위험물인 나이트로글리세린에 대한 다음 물음에 답하시오.
[풀이] 나이트로글리세린의 일반적 성질

① 다이너마이트, 로켓, 무연화약의 원료로 순수한 것은 무색투명한 기름성의 액체 (공업용 시판품은 담황색)이며 점화하면 즉시
연소하고 폭발력이 강하다.
② 물에는 거의 녹지 않으나 메탄올, 벤젠, 클로로포름, 아세톤 등에는 녹는다.
③ 다공질 물질을 규조토에 흡수시켜 다이너마이트를 제조한다.
④ 분자량 227, 비중 1.6, 융점 2.8℃, 비점 160 ℃
⑤ 위험성
▣ 40℃에서 분해되기 시작하고 145℃에서 격렬히 분해되며 200℃ 정도에서 스스로 폭발한다.
[정답] ①

② CO2, H2O, N2, O2
4. 다음 물질의 위험도를 구하시오.
① 디에틸에테르
② 아세톤
[풀이]
① 디에틸에테르의 물성 : 분자량 74.2, 비중 0.72, 비점 34℃, 인화점 -40℃, 발화점 180로 매우 낮고 연소범위 (1.9~48%)가
넓어 인화성, 발화성이 강하다.

② 아세톤의 물성 : 분자량 58, 비중 0.79, 비점 56℃, 인화점 -18.5℃, 발화점 465℃, 연소범위 2.5~12.8% 이며 휘발이 쉽고
상온에서 인화성 증기가 발생하며 작은 점화원에도 쉽게 인화한다.

[정답] ① 디에틸에테르 위험도 : 24.26
② 아세톤 위험도 4.12
5. 황화인에 대한 연소반응식을 적으시오.
① P4S3
② P2S5
[풀이] 알루미늄의 위험성
① 알루미늄 분말이 발화하면 다량의 열이 발생하며, 광택 및 흰 연기를 내면서 연소하므로 소화가 곤란하다.
4Al + 3O2 → 2Al2O3
② 대부분의 산과 반응하여 수소가 발생한다. (단, 진한 질산은 제외)
2Al + 6HCl → 2AlCl3 + 3H2
③ 알칼리 수용액과 반응하여 수소가 발생한다.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
④ 물과 반응하면 수소가스가 발생한다.
2Al + 6H2O → 2Al(OH)3 + 3H2
[정답]
① 2Al + 6H2O → 2Al(OH)3 + 3H2
② 2Al + 6HCl → 2AlCl3 + 3H2
7. 탱크 시험자가 갖추어야 할 기술장비 중 필수장비 4종류를 적으시오.
[풀이] 탱크시험자가 갖추어야 할 기술장비
① 기술능력
㉠ 필수인력
ⓐ 위험물기능장 · 위험물산업기사 또는 위험물기능사 중 1명 이상
ⓑ 비파괴검사기술사 1명 이상 또는 방사선비파괴검사 · 초음파비파괴검사 · 자기비파괴검사 및 침투비파괴검사별로 기사 또는
산업기사 각 1명 이상
㉡ 필요한 경우에 두는 인력
ⓐ 충 · 수압시험, 진공시험, 기밀시험 또는 내압시험의 경우 : 누설비파괴검사 기사, 산업기사 또는 기능사
ⓑ 수직 · 수평도 시험의 경우 : 측량 및 지형공간정보 기술사, 기사, 산업기사 또는 측량 기능사
ⓒ 필수인력의 보조 : 방사선비파괴검사 · 초음파비파괴검사 · 자기비파괴검사 또는 침투비파괴검사 기능사
② 시설 : 전용 사무실
③ 장비
㉠ 필수장비 : 방사선투과시험기, 초음파탐상시험기, 자기탐상시험기, 초음파두께 측정기
㉡ 필요한 경우에 두는 장비
ⓐ 충 · 수압시험, 진공시험, 기밀시험 또는 내압시험의 경우
⊙ 진공능력 53kPa 이상의 진공누설시험기
⊙ 기밀시험장치(안전장치가 부착된 것으로서 가압능력 200kPa 이상, 감압의 경우에는 감압능력 10kPa 이상 · 감도 10Pa
이하의 것으로서 각각의 압력 변화를 스스로 기록할 수 있는 것)
ⓑ 수직 · 수평도 시험의 경우 : 수직 · 수평도 측정기
[정답]
① 방사선투과시험기 ② 초음파탐상시험기 ③ 자기탐상시험기 ④ 초음파두께측정기
8. 제1류 위험물인 과산화칼슘에 대해 다음 물음에 답하시오.
① 열분해반응식
② 염산과의 반응식
[풀이] CaO2 (과산화칼슘)
① 일반적 성질
㉠ 분자량 72, 비중 1.7, 분해온도 275℃
㉡ 무정형의 백색 분말이며, 물에 녹기 어렵고 알코올이나 에테르 등에는 녹지 않음
㉢ 수화물(CaO2 · 8H2O)은 백색 결정이며, 물에는 조금 녹고 온수에서는 분해
② 위험성
㉠ 가열하면 275℃에서 분해되어 폭발적으로 산소를 방출
2CaO2 → 2CaO + O2
㉡ 산(HCl)과 반응하여 과산화수소를 생성
CaO2 + 2HCl → CaCl2 + H2O2
[정답] ① 2CaO2 → 2CaO + O2
② CaO2 + 2HCl → CaCl2 + H2O2
9. 에틸알코올 200g이 완전연소시 필요한 이론산소량(g)을 구하시오.
[풀이] 무색투명하며 인화가 쉽고 공기 중에서 쉽게 산화한다. 또한 완전연소를 하므로 불꽃이 잘 보이지 않으며 그을음이 거의 없다.

10. 제1류 위험물의 품명 중 행정안전부령이 정하는 품명 5가지를 적으시오.
[풀이] 제1류 위험물의 종류와 지정수량
|
성질
|
위험
등급
|
품명
|
대표품목
|
지정수량
|
|
산화성고체
|
Ⅰ
|
1. 아염소산염류
2. 염소산염류
3. 과염소산염류
4. 무기과산화물류
|
NaClO2, KClO2
NaClO3, KClO3, NH4ClO3
NaClO4, KClO4, NH4ClO4
K2O2, Na2O2, MgO2
|
50㎏
|
|
Ⅱ
|
5. 브로민산염류
6. 질산염류
7. 아이오딘산염류
|
KBrO3
KNO3, NaNO3, NH4NO3
KIO3
|
300㎏
|
|
|
Ⅲ
|
8. 과망가니즈산염류
9. 다이크로뮴산염류
|
KMnO4
K2Cr2O7
|
1,000㎏
|
|
|
Ⅰ~Ⅲ
|
10. 그밖에 행정안전부령이 정하는 것
① 과아이오딘산염류
② 과아이오딘산
③ 크로뮴,납 또는 아이오딘산의 산화물
④ 아질산염류
⑤ 차아염소산염류
⑥ 염소화아이소시아눌산
⑦ 퍼옥소이황산염류
⑧ 퍼옥소붕산염류
11. 1~10호의 하나 이상을 함유한 것
|
KIO4
HIO4
CrO3
NaNO2
LiClO
OCNClONCICONCl
NaBO3
|
50㎏.
300㎏
또는
1,000㎏
|
[정답]
① 과아이오딘산염류
② 과아이오딘산
③ 크로뮴, 납 또는 아이오딘의 산화물
④ 아질산염류
⑤ 차아염소산염류
11. 다음은 제1류, 제4류, 제5류 위험물에 대한 설명이다. 괄호 안을 적당히 채우시오.
① 제1류 위험물의 품명은 아염소산염류, 염소산염류, 과염소산염류, 무기과산화물류, 브로민산염류, 질산염류, ( ㉠ ), ( ㉡ ),
( ㉢ ), 그밖에 행정안전부령이 정하는 것을 말한다.
② 제4류 위험물의 지정수량은 제1석유류의 비수용성은 ( ㉠ ) ℓ, 수용성은 ( ㉡ ) ℓ, 제2석유류의 비수용성은 ( ㉢ ) ℓ, 수용성은
( ㉡ )ℓ이다.
③ 제5류 위험물의 품명은 유기과산화물, 질산에스터류, 하이드록실아민, 하이드록실아민염류, 나이트로화합물류, 나이트로소화
합물류, ( ㉠ ), ( ㉡ ), ( ㉢ ), 그 밖에 행정안전부령이 정하는 것을 말한다.
[정답] ① ㉠ 아이오딘산염류 ㉡ 과망가니즈산염류 ㉢ 다이크로뮴산염류
② ㉠ 200 ㉡ 400 ㉢ 1,000 ㉣ 2,000
③ ㉠ 아조화합물 ㉡ 아이아조화합물 ㉢ 하이드라진유도체
12. 위험물을 소비하는 작업에 있어서의 취급기준 3가지를 적으시오.
① 분사도장작업은 방화상 유효한 격벽 등으로 구획된 안전한 장소에서 실시할 것
② 담금질 또는 열처리작업은 위험물이 위험한 온도에 이르지 아니하도록 하여 실시한 것
③ 버너를 사용하는 경우에는 버너의 역화를 방지하고 위험물이 넘치지 아니하도록 할 것
13. 다음 [보기] 중 옥외저장소에서 저장 · 취급할 수 있는 위험물을 쓰시오.
[보기] 이황화탄소, 질산, 에탄올, 아세톤, 질산에스터류, 과염소산염류, 황, 인화성 고체 (5℃ 이상)
[풀이] 옥외저장소에 저장할 수 있는 위험물
㉠ 제2류 위험물 중 황, 인화성 고체 (인화점이 0℃ 이상인 것에 한함)
㉡ 제4류 위험물 중 제1석유류 (인화점이 0℃ 이상인 것에 한함), 제2석유류, 제3석유류, 제4석유류, 알코올류, 동식물유류
㉢ 제6류 위험물
[정답] 황, 질산, 에탄올, 인화성 고체 (5℃ 이상)
14. 제4류 위험물인 벤젠에 대하여 다음 물음에 답하시오.
① 연소반응식
② 분자량
③ 지정수량
[풀이] 벤젠은 제4류 위험물로서 제1석유류에 속하며 비수용성 액체로서 지정수량은 200ℓ이다. 분자량 78, 비중 0.9, 비점 80℃,
인화점 -11℃, 발화점 498℃, 연소범위 1.4 ~ 7.1%로 80.1℃에서 끓고, 5.5℃에서 응고된다. 겨울철에는 응고된 상태
에서도 연소가 가능하다. 무색 투명하며 독특한 냄새를 가진 휘발성이 강한 액체로 위험성이 높으며 인화가 쉽고 다량의 흑연
을 발생하고 뜨거운 열을 내며 연소한다.
2C6H6 + 7.5O2 → 6CO2 + 6H2O
[정답] ① 2C6H6 + 7.5O2 → 6CO2 + 6H2O
② 78g
③ 200 ℓ
15. 제1종 분말소화약제의 주성분인 탄산수소나트륨의 분해반응식을 쓰고, 8.4g의 탄산수소나트륨이 반응하여 생성되는 이산화탄
소의 부피(ℓ)를 구하시오.
[풀이] 탄산수소나트륨은 약 60℃ 부근에서 분해되기 시작하여 270℃에서 다음과 같이 열분해된다.
2NaHCO2 → Na2CO3 + H2O + CO2 (at 270℃)
(중탄산나트륨) (탄산나트륨) (수증기) (탄산가스)

[정답] 1.12ℓ
16. 옥외저장소 특례에 의하면 위험물을 저장 또는 취급하는 장소에는 해당 위험물을 적당한 온도로 유지하기 위한 살수설비 등을
설치하여야 한다. 이 위험물의 종류를 쓰시오.
[풀이] 인화성 고체, 제1석유류 또는 알코올류의 옥외저장소의 특례
㉠ 인화성 고체, 제1석유류 또는 알코올류를 저장 또는 취급하는 장소에는 해당 위험물을 적당한 온도로 유지하기 위한 살수설비
등을 설치하여야 한다.
㉡ 제1석유류 또는 알코올류를 저장 또는 취급하는 장소의 주위에는 배수구 및 집유설비를 설치하여야 한다. 이 경우 제1석유류
(20℃의 물 100g에 용해되는 양이 1g 미만인 것에 한한다)를 저장 또는 취급하는 장소에 있어서는 집유설비에 유분리장치를
설치하여야 한다.
[정답] ① 인화성 고체 ② 제1석유류 ③ 알코올류
17. 다음은 옥외탱크저장소의 방유제에 대한 설명이다. 괄호 안을 알맞게 채우시오.
① 방유제 내에 설치하는 옥외저장탱크의 수는 10 [방유제 내에 설치하는 모든 옥외저장탱크의 용량이 ( ㉠ ) ℓ 이하이고, 해당 옥외
저장탱크에 저장 또는 취급하는 위험물의 인화점이 70℃ 이상, 200℃ 미만인 경우에는 20]이하로 할 것. 다만, 인화점이 ( ㉡ )
℃ 이상인 위험물을 저장 또는 취급하는 옥외저장탱크에 있어서는 그러하지 아니하다.
② 방유제 외면의 2분의 1 이상은 자동차 등이 통행할 수 있는 ( ) m 이상의 노면폭을 확보한 구내도로 (옥외저장탱크가 있는 부지
내의 도로를 말한다)에 직접 접하도록 할 것. 다만, 방유제 내에 설치하는 옥외저장탱크의 용량 합계가 20만 ℓ 이하인 경우에는
소화활동에 지장이 없다고 인정되는 3m 이상의 노면폭을 확보한 도로 또는 공지에 접하는 것으로 할 수 있다.
③ 방유제는 옥외저장탱크의 지름에 따라 그 탱크의 옆판으로 부터 다음에 정하는 거리를 유지할 것. 다만, 인화점이 200℃ 이상인
위험물을 저장 또는 취급하는 것에 있어서는 그러하지 아니하다.
㉠ 지름이 15m 미만인 경우에는 탱크 높이의 ( ) 이상
㉡ 지름이 15m 이상인 경우에는 탱크 높이의 ( ) 이상
[풀이] 옥외탱크저장소의 방유제 설치기준
① 설치목적 : 저장중인 액체 위험물이 주위로 누설시 그 주위에 피해 확산을 방지하기 위하여 설치한 담
② 용량 : 방유제 안에 설치된 탱크가 하나인 때에는 그 탱크 용량의 110% 이상, 2기 이상인 때에는 그 탱크 용량 중 용량이 최대인
것의 용량의 110% 이상으로 한다. 다만, 인화성이 없는 액체 위험물의 옥외저장탱크의 주위에 설치하는 방유제는
"110%"를 "100%"로 본다.
③ 높이 0.5m 이상 3.0m 이하, 면적 80,000㎡ 이하, 두께 0.2m 이상, 지하매설깊이 1m 이상으로 할 것. 다만, 방유제와 옥외저장
탱크 사이의 지반면 아래에 불침윤성 구조물을 설치하는 경우에는 지하매설깊이를 해당 불침윤성 구조물까지로 할 수 있다.
④ 방유제는 외면의 2분의 1 이상은 자동차 등이 통행할 수 있는 3m 이상의 노면폭을 확보한 구내도로에 직접 접하도록 한다.
⑤ 하나의 방유제 안에 설치되는 탱크의 수 10기 이하 (단, 방유제 내 전 탱크의 용량이 200kℓ 이하이고, 인화점이 70℃ 이상,
200℃ 미만인 경우에는 20기 이하)
⑥ 방유제와 탱크 측면과의 이격거리
㉠ 탱크 지름이 15m 미만인 경우 : 탱크 높이의 1/3 이상
㉡ 탱크 지름이 15m 이상인 경우 : 탱크 높이의 1/2 이상
[정답] ① ㉠ 20만 ㉡ 200
② 3
③ ㉠ 1/3 ㉡ 1/2
18. 유량이 230 ℓ/s인 유체가 D = 250에서 D =400로 관경이 확장되었을 때 손실수두는 얼마가 되는지 구하시오. (단, 손실계수는
무시)
[풀이]

[정답] 0.42 m
19. 주유취급소에 설치할 수 있는 건축물 5가지를 쓰시오.
[풀이] 주유취급소에 설치할 수 있는 건축물
① 주유 또는 등유 · 경유를 옮겨 담기 위한 작업장
② 주유취급소의 업무를 행하기 위한 사무소
③ 자동차 등의 점검 및 간이정비를 위한 작업장
④ 자동차 등의 세정을 위한 작업장
⑤ 주유취급소에 출입하는 사람을 대상으로 한 점포 · 휴게음식점 또는 전시장
⑥ 주유취급소에 관계자가 거주하는 주거시설
⑦ 전기자동차용 충전설비 (전기를 동력원으로 하는 자동차에 직접 전기를 공급하는 설비를 말한다)
⑧ 그밖에 소방청장이 정하여 고시하는 건축물 또는 시설
⑨ 상기 ②,③ 및 ⑤의 용도에 제공하는 부분의 면적의 합은 1,000㎡를 초과할 수 없다.
[정답]
① 주유 또는 등유 · 경유를 옮겨 담기 위한 작업장
② 주유취급소의 업무를 행하기 위한 사무소
③ 자동차 등의 점검 및 간이정비를 위한 작업장
④ 자동차 등의 세정을 위한 작업장
⑤ 주유취급소에 출입하는 사람을 대상으로 한 점포 · 휴게음식점 또는 전시장
⑥ 주유취급소에 관계자가 거주하는 주거시설
20. 강제 강화 플라스틱 이중벽 탱크의 누설감지설비의 기준에 대한 설명이다. 괄호안을 알맞게 채우시오.
① 감지층에 누설된 위험물 등을 감지하기 위한 센서는 ( ㉠ ) 또는 ( ㉡ ) 등으로 하고, 검지관 내로 누설된 위험물 등의 수위가
( ㉢ ) ㎝ 이상인 경우에 감지할 수 있는 성능 또는 누설량이 ( ㉣ ) ℓ 이상인 경우에 감지할 수 있는 성능이 있을 것
② 누설감지설비는 센서가 누설된 위험물 등을 감지한 경우에 경보신호(경보음 및 경보 표시)를 발하는 것으로 하되, 해당 경보
신호가 쉽게 정지될 수 없는 구조로 하고 경보음은 ( )dB 이상으로 할 것
[풀이] 강제 강화 플라스틱제 이중벽 탱크의 누설감지설비의 기준
① 누설된 위험물을 감지할 수 있는 설비기준
㉠ 누설감지설비는 탱크 본체의 손상 등에 의하여 감지층에 위험물이 누설되거나 강화 플라스틱 등의 손상 등에 의하여 지하수가
감지층에 침투하는 현상을 감지하기 위하여 감지층에 접속하는 검지관에 설치된 센서 및 해당 센서가 작동한 경우에 경보를
발생하는 장치로 구성되도록 할 것
㉡ 경보표시장치는 관계인이 상시 쉽게 감시하고 이상상태를 인지할 수 있는 위치에 설치할 것
㉢ 감지층에 누설된 위험물 등을 감지하기 위한 센서는 액체플로트센서 또는 액면계 등으로 하고, 검지관 내로 누설된 위험물 등
의 수위가 3㎝ 이상인 경우에 감지할 수 있는 성능 또는 누설량이 1ℓ 이상인 경우에 감지할 수 있는 성능이 있을 것
㉣ 누설감지설비는 센서가 누설된 위험물 등을 감지한 경우에 경보신호 (경보음 및 경보 표시)를 발하는 것으로 하되, 해당 경보
신호가 쉽게 정지될 수 없는 구조로 하고 경보음은 80dB 이상으로 할 것
② 누설감지설비는 상기 규정에 따른 성능을 갖도록 이중벽탱크에 부착할 것. 다만, 탱크제작지에서 탱크매설장소로 운반하는
과정 또는 매설 등의 공사 작업시 누설감지설비의 손상이 우려되거나 탱크매설 현장에서 부착하는 구조의 누설감지설비는
그러하지 아니하다.
[정답] ① ㉠ 액체플로트센서 ㉡ 액면계 ㉢ 3 ㉣ 1
② 80
#위험물 #기능장 #분자량 #나이트로글리세린 #위험도 #디에틸에테르 #아세톤 #황화인
#방사선투과시험기 #알루미늄 #과산화칼슘 #메틸알코올 #분말소화약제 #옥외탱크저장소
'위험물 기능장 실기' 카테고리의 다른 글
| 위험물기능장 실기 제58회 2015년 9월 5일 시행 (2) | 2025.07.06 |
|---|---|
| 위험물 기능장 실기 제57회 (2015년 5월 23일) (6) | 2025.06.27 |
| 위험물 기능장 제55회 2014년 5월 25일 시행 (7) | 2025.06.19 |
| 위험물기능장 실기 제54회 2013년 9월 1일 시행 (4) | 2025.06.18 |
| 소화활동설비 (2) | 2025.06.15 |