
1. 포소화설비에서 포소화약제 혼합장치의 4가지 방식을 쓰시오.
[풀이] 포소화약제의 혼합장치
① 펌프혼합방식 (펌프 프로포셔너)
펌프의 토출관과 흡입관 사이의 배관 도중에 설치한 흡입기에 펌프에서 토출된 물의 일부를 보내고 농도조절밸브에서
조정된 포소화약제의 필요량을 포소화약제 탱크에서 펌프 흡입측으로 보내어 이를 혼합하는 방식
② 차압 혼합방식 (프레져 프로포셔너 방식)
펌프와 발포기 중간에 설치된 벤투리관의 벤투리 작용과 펌프 가압수의 포소화약제 저장태크에 대한 압력에 의하여
포소화약제를 흡입 · 혼합하는 방식
③ 관로 혼합방식 (라인 프로포셔너 방식)
펌프와 발포기 중간에 설치된 벤투리관의 벤투리 작용에 의하여 포소화약제를 흡입하여 혼합하는 방식
④ 압입 혼합방식 (프레져 사이드 프로포셔너 방식)
펌프의 토출관에 압입기를 설치하여 포소화약제 압입용 펌프로 포소화약제를 압입시켜 혼합하는 방식
[정답] 펌프프로포셔너 방식, 프레져 프로포셔너 방식, 라인 프로포셔너 방식, 프레져 사이드 프로포셔너 방식
2. 다음은 위험물 제조소 건축물의 구조기준에 대한 설명이다. 다음 물음에 답하시오.
① 불연재료로 해야 하는 사용장소 5가지 : 벽, 기둥, 바닥, 보, 서까래, 계단
② 연소의 우려가 있는 외벽은 개구부가 없는 (내화구조)의 벽으로 해야 한다.
③ 지붕의 구조 : 폭발력이 위로 방출될 정도의 가벼운 불연재료
④ 액체의 위험물을 취급하는 건축물의 바닥기준 2가지
㉠ 위험물이 스며들지 못하는 재료 ㉡ 집유설비
3. 수계소화설비 점검기구를 5가지 쓰시오.
[정답] 방수압력측정계, 절연저항계, 전류전압측정계, 소화전밸브압력계, 헤드결합렌치
4. 국제해상위험물규칙에 따른 제8등급에 대하여 답하시오. [출제기준에서 삭제]
5. 트리나이트로톨루엔 (T.N.T)의 제법 및 분해시 화학반응식을 쓰시오.
① 1몰의 톨루엔과 3몰의 질산을 황산 촉매하에 반응시키면 나이트로화에 의해 T.N.T가 만들어 진다.
|
C6H5CH3
|
+ 3HNO3
|
c - H2SO4
|
T.N.T
|
+ 3H2O
|
|
→ 나이트로화
|
② K, KOH, HCl, Na2Cr2O7 과 접촉시 조건에 따라 발화하거나 충격, 마찰에 민감하고 폭발 위험성이 있으며, 분해되면
다량의 기체가 발생하고 불완전연소시 유독성의 질소 화합물과 CO를 발생한다.
2C6H2CH3(NO2)3 → 12 CO + 2C + 3N2 + 5H2
[정답]
① 1몰의 톨루엔과 3몰의 질산을 황산 촉매하에 반응시키면 나이트로화에 의해 T.N.T가 만들어 진다.
C6H5CH3 + 3HNO3 → (c- H2SO4, 나이트로화) C6H2CH3(NO2)3 + 3H2O

② 2C6H2CH3(NO2)3 → (분해) 12CO + 2C + 3N2 + 5H2
6. 분자량이 78이고 무색투명한 액체로 방향성이 있으며, 인화점이 -11℃ 이다. 이 물질 2㎏이 산소와 반응할 때 반응식과
이론산소량(kg)을 구하시오.
[벤젠(C6H6)의 일반적 성질]
㉠ 무색 투명하며 독특한 냄새를 가진 휘발성이 강한 액체로, 위험성이 강하며 인화가 쉽고 다량의 흑연이 발생하고
뜨거운 열을 내며 연소한다.
㉡ 물에는 녹지 않으나 알코올, 에테르 등 유기용제에는 잘 녹으며, 유지, 수지, 고무 등을 용해시킨다.
㉢ 분자량 78, 비중 0.9, 비점 79℃, 인화점 -11℃, 발화점 498℃, 연소범위 1.4 ~8.0% 로 79℃에서 끓고, 5.5℃ 에서 응고된
다. 겨울철에는 응고된 상태에서도 연소가 가능하다.
㉣ 연소시 이산화탄소와 물이 생성된다.
a C6H6 + b O2 → c CO2 + d H2O
C : 6a = c
H : 6a = 2d
O : 2b = 2c + d
a = 1이라면 C= 6, d=3, 2b = 12 + 3, b=15/2 =7.5
a=2, b=15, c= 12, d = 6
2C6H6 + 15O2 → 12CO2 + 6 H2O
|
2kg - C6H6
|
1 kmol-C6H6
|
15 kmol - O2
|
32 kg - O2
|
= 6.15 kg - O2
|
|
|
78 kg - C6H6
|
1 kmol - C6H6
|
1 kmol - O2
|
|
[정답]
① 2C6H6 + 15O2 → 12CO2 + 6 H2O
② 6.15 kg
7. 위험물 저장소의 일반점검표에서 전기설비의 접지 점검내용을 쓰시오.
[풀이] 옥내저장소 일반 점검표
|
환기 · 배출 설비 등
|
변형·손상의 유무 및 고정상태의 적부
|
육안
|
|
|
인화방지망의 손상 및 막힘 유무
|
육안
|
||
|
방화댐퍼의 손상 유무 및 기능의 적부
|
육안 및 작동확인
|
||
|
팬의 작동상황의 적부
|
작동확인
|
||
|
가연성 증기 경보장치의 작동상황
|
작동확인
|
||
|
집유설비 · 배수구
|
균열 · 손상 등의 유무
|
육안
|
|
|
체유 · 체수 · 토사 등의 퇴적 유무
|
육안
|
||
|
전기
설비
|
배전반·차단기 · 배선 등
|
변형 · 손상의 유무
|
육안
|
|
고정상태의 적부
|
육안
|
||
|
기능의 적부
|
육안 및 작동확인
|
||
|
배선 접합부의 탈락의 유무
|
육안
|
||
|
접지
|
단선의 유무
|
육안
|
|
|
부착부분의 탈락의 유무
|
육안
|
||
|
접지저항치의 적부
|
저항측정
|
||
|
피뢰설비
|
돌침부의 경사 · 손상 · 부착 상태
|
육안
|
|
|
피뢰도선의 단선 및 벽체 등과 접촉의 유무
|
육안
|
||
|
접지저항치의 적부
|
저항치 측정
|
||
[정답] ① 단선의 유무 ② 부착부분의 탈락 유무 ③ 접지저항치의 적부
8. 에탄올이 140℃ 에서 진한황산과 반응하면 특수 인화물에 해당하는 물질이 생성된다.
이물질의 위험도를 구하시오.
[풀이] ㉮ 140℃ 에서 진한황산과 반응해서 디에틸에테르를 생성한다.
2C2H5OH → (c-H2SO4) C2H5OC2H5 + H2O
㉯ 디에틸에테르의 일반적 성질
㉠ 무색투명한 유동성 액체로 휘발성이 크며, 에탄올과 나트륨이 반응하면 수소가 발생하지만 에테르는 나트륨과 반응
하여 수소가 발생하지 않으므로 구별할 수 있다.
㉡ 물에는 약간 녹고 알코올 등에는 잘 녹으며, 증기는 마취성이 있다.
㉢ 전기의 부도체로서 정전기가 발생하기 쉽다.
㉣ 분자량 74.12, 비중 0.72, 비점 34 ℃, 인화점 -40℃, 발화점 180℃ 로 매우 낮고 연소범위는 1.9 ~ 48%로 넓어 인화성,
발화성이 강하다.
[정답]

9. 위험물 탱크 시험자가 갖추어야 할 시설과 필수장비 3가지를 쓰시오.
[풀이]
<탱크시험자가 갖추어야 할 기술 장비>
㉮ 기술능력
① 필수인력
㉠ 위험물기능장 · 위험물산업기사 또는 위험물기능사 중 1명 이상
㉡ 비파괴검사기술사 1명 이상 또는 방사선비파괴검사 · 초음파비파괴검사 · 자기비파괴검사 및 침투비파괴검사별로
기사 또는 산업기사 각 1명 이상
② 필요한 경우에 두는 인력
㉠ 충 · 수압시험, 진공시험, 기밀시험 또는 내압시험의 경우 : 누설비파괴검사 기사, 산업기사 또는 기능사
㉡ 수직 · 수평도 시험의 경우 : 측량 및 지형공간정보 기술사, 기사, 산업기사 또는 측량 기능사
㉢ 필수인력의 보조 : 방사선비파괴검사 · 초음파비파괴검사 · 자기비파괴검사 또는 침투 비파괴검사 기능사
㉯ 시설 : 전용 사무실
㉰ 장비
① 필수장비 : 방사선투과시험기, 초음파탐상시험기, 자기탐상시험기, 초음파두께측정기
② 필요한 경우에 두는 장비
㉠ 충 · 수압시험, 진공시험, 기밀시험 또는 내압시험의 경우
ⓐ 진공능력 53kPa 이상의 진공누설시험기
ⓑ 기밀시험장치(안전장치가 부착된 것으로서 가압능력 200kPa 이상, 감압의 경우에는 감압능력 10kPa 이상 · 감도
10Pa 이하의 것으로서 각각의 압력 변화를 스스로 기록할 수 있는 것)
㉡ 수직 · 수평도 검사의 경우 : 수직 · 수평도 측정기
[정답]
① 시설 : 전용사무실
② 필수장비 : 방사선투과시험기, 초음파탐상시험기, 자기탐상시험기, 초음파투께측정기
10. 위험물 운반용기의 외부 표시사항을 적으시오.
[풀이]
▣ 위험물 적재방법
⊙ 위험물은 그 운반용기의 외부에 다음에 정하는 바에 따라 위험물의 품명, 수량 등을 표시하여 적재하여야 한다.
① 위험물의 풍명 · 위험등급 · 화학명 및 수용성 ('수용성' 표시는 제4류 위험물로서 수용성인 것에 한한다.)
② 위험물의 수량
③ 수납하는 위험물에 따라 주의사항을 표시한다.
|
유별
|
구분
|
주의사항
|
|
제1류 위험물
(산화성 고체)
|
알칼리금속의 무기과산화물
|
"화기 · 충격주의"
"물기엄금"
"가연물접촉주의"
|
|
그밖의 것
|
"화기 · 충격주의"
"가연물접촉주의"
|
|
|
제2류 위험물
(가연성 고체)
|
철분 · 금속분 · 마그네슘
|
"화기주의"
"물기엄금"
|
|
인화성 고체
|
"화기엄금"
|
|
|
그밖의 것
|
"화기주의"
|
|
|
제3류 위험물
(자연발화성 및
금수성 물질)
|
자연발화성 물질
|
"화기엄금"
"공기접촉엄금"
|
|
금수성 물질
|
"물기엄금"
|
|
|
제4류 위험물
(인화성 액체)
|
-
|
"화기엄금"
|
|
제5류 위험물
(자기반응성 물질)
|
-
|
"화기엄금" 및 "충격주의"
|
|
제6류 위험물
(산화성 액체)
|
-
|
"가연물 접촉주의"
|
[정답]
① 위험물의 풍명 · 위험등급 · 화학명 및 수용성 ('수용성' 표시는 제4류 위험물로서 수용성인 것에 한한다.)
② 위험물의 수량
③ 주의사항
11. 제6류 위험물인 질산 31.5g을 물에 녹여 360g을 만들었다. 이 질산수용액의 몰분율과 몰농도를 구하시오. (단, 수용액
의 비중은 1.1이다)
[풀이]
물의 질량 = 360g - 31.5 g = 328.5 g

한편, 질산수용액의 비중이 1.1이므로 이를 이용하여 질산수용액의 부피를 구하면

[정답] ① 몰분율 : 0.027 ② 몰농도(M) : 1.53
12. 분자량 170, 융점 212℃, 무색 무취의 투명한 결정인 제1류 위험물질에 대해 다음 물음에 답하시오.
① 지정수량 : 300 ㎏
② 가열시 분해반응식 : 2AgNO3 → 2Ag + 2NO2 + O2
[풀이]
<질산은 (AgNO3)>
㉠ 무색무취의 투명한 결정으로 물, 아세톤, 알코올, 글리세린에 잘 녹는다.
㉡ 분자량 : 170, 융점 : 212℃, 비중 : 4.35, 445℃로 가열하면 산소가 발생한다.
㉢ 아이오딘에틸시안과 혼합하면 폭발성 물질이 형성되며, 햇빛에 의해 변질되므로 갈색병에 보관해야 한다. 사진 감광
제, 부식제, 은도금, 사진제판, 촉매 등으로 사용된다.
㉣ 분해반응식 : 2AgNO3 → 2Ag + 2NO2 + O0
13. 방폭구조의 종류 4가지를 쓰시오.
[정답] ① 압력방폭구조 ② 유입방폭구조 ③ 안전증방폭구조 ④ 본질안전방폭구조
[풀이]
① 압력방폭구조 : 용기내부에 질소 등의 보호용 가스를 충전하여 외부에서 폭발성 가스가 침입하지 못하도록 한 구조
② 유입방폭구조 : 전기불꽃, 아크 또는 고온이 발생하는 부분을 기름 속에 넣어 폭발성 가스에 의해 인화가 되지 않도록
한 구조
③ 안전증 방폭구조 : 기기의 정상운전 중에 폭발성 가스에 으해 점화원이 될 수 있는 전기 불꽃 또는 고온이 되어서는
안 될 부분에 기계적, 전기적으로 특히 안전도를 증가시킨 구조
④ 본질안전방폭구조 : 폭발성 가스가 단선, 단락, 지락 등에 의해 발생하는 전기불꽃, 아크 또는 고온에 의하여 점화되지
않는 것이 확인된 구조
⑤ 내압방폭구조 : 대상 폭발성 가스에 대하여 점화능력을 가진 전기불꽃 또는 고온 부위에 있어서도 기기 내부에서 폭발
성 가스의 폭발이 발생하여도 기기가 그 폭발압력에 견디고 또한 기기 주위의 폭발성 가스에 인화 · 파급
하지 않도록 되어 있는 구조를 말한다.
14. 위험물제조소 등에 할로겐화합물소화설비를 설치할 때 축압식 저장용기 등은 21℃에서 할론 1211을 저장하는 것은
( ① )MPa 또는 ( ② ) MPa, 할론 1301을 저장하는 것은 ( ③ ) MPa 또는 ( ④ ) MPa 이 되도록 ( ⑤ ) 가스로 가압해야
한다. 괄호 안을 알맞게 채우시오.
[정답] ① 1.1 ② 2.5 ③ 2.5 ④ 4.2 ⑤ 질소
[풀이] 축압식 저장용기 등은 21℃ 에서 할론 1211을 저장하는 것은 1.1MPa 또는 2.5MPa, 할론 1301 또는 HFC-227ea를
저장하는 것은 2.5MPa 또는 4.2MPa 이 되도록 질소가스로 가압할 것
15. 옥외탱크저장소에서 탱크통기장치의 기준 중 밸브 없는 통기관의 설치기준을 적으시오.
[정답]
① 통기관의 직경 : 30 ㎜ 이상
② 통기관의 선단은 수평으로 부터 45° 이상 구부려 빗물 등의 침투를 막는 구조일 것
③ 가는 눈의 구리망 등으로 인화방지망을 설치할 것
④ 가연성 증기를 회수하기 위한 밸브를 통기관에 설치하는 경우에 있어서는 해당 통기관의 밸브는 저장탱크에 위험물을
주입하는 경우를 제외하고는 항상 개방되어 있는 구조로 하는 한편 폐쇄하였을 경우에 있어서는 10kPa 이하의 압력에
서 개방되는 구조로 할 것. 이 경우 개방된 부분의 유효단면적은 777.15㎟ 이상이어야 함
16. 이동탱크저장소에 방호틀을 설치하고자 한다. 스테인리스 규격이 130N/㎟일 때 방호틀의 두께는 얼마로 해야 하는지
구하시오.
[정답] 3.31 ㎜ 이상
[풀이] 이동탱크저장소의 구조 및 재료 기준
① 이동저장탱크의 탱크 · 칸막이 · 맨홀 및 주입관의 뚜껑 KS 규격품인 스테인리스강판, 알루미늄합금판, 고장력강판으
로서 두께가 다음 식에 의하여 산출된 수치 (소수점 2자리 이하는 올림) 이상으로 하고 판 두께의 최소치는 2.8㎜ 이상
일 것. 다만, 최대용량이 20 ㎘를 초과하는 탱크를 알루미늄합금판으로 제작하는 경우에는 다음 식에 의하여 구한 수치
에 1.1를 곱한 수치로 한다.

여기서, t : 사용재질의 두께 (㎜)
σ : 사용재질의 인장강도 (N/㎟)
A : 사용재질의 신축률 (%)
② 이동저장탱크의 방파판
KS 규격품인 스테인리스강판, 알루미늄합금판, 고장력강판으로서 두께가 다음 식에 의하여 산출된 수치(소수점 2자리
이하는 올림) 이상으로 한다.
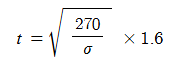
여기서, t : 사용재질의 두께 (㎜)
σ : 사용재질의 인장강도 (N/㎟)
③ 이동저장탱크의 방호틀
KS 규격품인 스테인리스강판, 알루미늄합금판, 고장력강판으로서 두께가 다음 식에 의하여 산출된 수치 (소수점 2자
리 이하는 올림) 이상으로 한다.

여기서, t : 사용재질의 두께 (㎜)
σ : 사용재질의 인장강도 (N/㎟)

17. 분말소화약제 4종류에 대한 주성분의 화학식과 종류별 색깔을 쓰시오.
[풀이]
|
종류
|
주성분
|
화학식
|
착색
|
적응화재
|
|
제1종
|
탄산수소나트륨
(중탄산나트륨)
|
NaHCO3
|
-
|
B,C 급 화재
|
|
제2종
|
탄산수소칼륨
(중탄산칼륨)
|
KHCO3
|
담회색
|
B, C급 화재
|
|
제3종
|
제1인산암모늄
|
NH4H2PO4
|
담홍색 또는 황색
|
A,B,C급 화재
|
|
제4종
|
탄산수소칼륨+요소
|
KHCO3+CO(NH2)2
|
-
|
B, C급 화재
|
[정답]
제1종 : NaHCO3
제2종 : KHCO3, 담회색
제3종 : NH4H2PO4, 담홍색 또는 황색
제4종 : KHCO3 + CO(NH2)2
18. 무색 또는 오렌지색의 분말로 분자량 110인 제1류 위험물 중 무기과산화물류에 속하는 물질로서, 다음 물질과의 반응
식을 쓰시오.
① 물 : 2K2O2 + 2H2O → 4KOH + O2
② 황산 : K2O2 + H2SO4 → K2SO4 + H2O2
③ 이산화탄소 : 2K2O2 + 2CO2 → 2K2CO3 + O2
[풀이]
K2O2 (과산화칼륨)의 일반적 성질
㉠ 분자량 110, 비중은 20℃에서 2.9, 융점 490℃
㉡ 순수한 것은 백색이나 보통은 오렌지색의 분말 또는 과립상으로 흡습성, 조해성이 강하다.
㉢ 가열하면 열분해되어 산화칼륨(K2O)과 산소(O2) 발생
2K2O2 → 2K2O + O2
㉣ 흡습성이 있으므로 물과 접촉하면 발열하며 수산화칼륨(KOH)과 산소(O2) 발생
2K2O2 + 2H2O → 4KOH + O2
㉤ 공기중의 탄산가스를 흡수하여 탄산염을 생성
2K2O2 + CO2 → 2K2CO3 + O2
㉥ 에틸알코올에는 용해되며, 묽은 산과 반응하여 과산화수소(H2O2)를 생성
K2O2 + 2CH3COOH → 2CH3COOK + H2O2
㉦ 황산과 반응하여 황산칼륨과 과산화수소를 생성
K2O2 + H2SO4 → K2SO4 + H2O2
19. 위험물제조소에 국소방출방식으로 가로 6m, 세로 8m, 높이 4m에 해당하는 배출설비를 설치하려고 한다. 이 때의 배출
용량을 구하시오.
[정답] 3,840 ㎥/h
[풀이] 배출능력은 1시간당 배출장소 용적의 20배 이상인 것으로 하여야 한다.
다만, 전역방식의 경우에는 바닥면적 1㎡당 18㎥ 이상으로 할 수 있다.
따라서, 8m × 6m × 4m × 20배 = 3,840 ㎥/h
20. 이동탱크저장소에 대한 설명이다. ( )안에 알맞은 말을 쓰시오.
① 안전장치 작동압력의 경우 상용압력이 ( ㉠ )kPa 이하인 탱크에 있어서는 ( ㉡ ) kPa 이상, ( ㉢ ) kPa 이하의 압력에서
작동하는 것으로 할 것
② 방파판의 두께는 ( ) ㎜ 이상의 강철판 또는 이와 동등 이상의 강도, 내열성 및 내식성이 있는 금속성의 것으로 할 것
[정답] ① ㉠ 20 ㉡ 20 ㉢ 24
② 1.6
[풀이]
① 안전장치 작동압력
㉠ 설치목적 : 이동탱크의 내부압력이 상승할 경우 안전장치를 통하여 압력을 방출하여 탱크를 보호하기 위함
㉡ 상용압력이 20kPa 이하 : 20kPa 이상, 24kPa 이하의 압력
㉢ 상용압력이 20kPa 초과 : 상용압력의 1.1배 이하의 압력
② 방파판 설치기준
㉠ 재질은 두께 1.6 ㎜ 이상의 강철판으로 제작
㉡ 출렁임 방지를 위해 하나의 구획부분에 2개 이상의 방파판을 이동탱크저장소의 진행방향과 평행으로 설치하되,
그 높이와 칸막이로 부터의 거리를 다르게 할 것
㉢ 하나의 구획부분에 설치하는 각 방파판의 면적 합계는 해당 구획부분의 최대수직단면적의 50 % 이상으로 할 것.
다만, 수직 단면이 원형이거나 짧은 지름이 1m 이하의 타원형인 경우에는 40% 이상으로 할 수 있다.
#분자량 #분말소화기 #위험물 #톨루엔 #벤젠 #포소화설비 #내화구조 #위험도 #방향성
#가연성 #산화성 #자연발화성 #금수성 #몰분율 #몰농도 #축압식 #질소 #방폭구조
'위험물 기능장 실기' 카테고리의 다른 글
| 위험물기능장 실기 제50회 (2011년) (2) | 2025.03.09 |
|---|---|
| 위험물기능장 실기 제49회 2011년 (4) | 2025.03.09 |
| 위험물기능장 실기 제47회 2010년 (2) | 2025.03.03 |
| 주기율표와 원소 (0) | 2025.02.28 |
| 화학반응식 (0) | 2025.02.27 |





















































