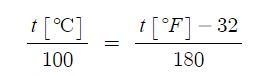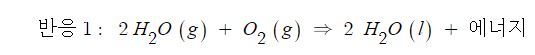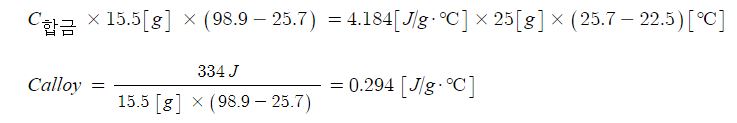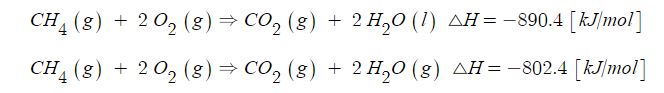1. 화학반응과 에너지
2. 발열반응과 흡열반응
3. 엔탈피
4. 열량계와 열용량
5. 열화학 반응식
1. 화학반응과 에너지
▣ 얼음이 녹기 위해서는 에너지 공급이 필요
⊙ H2O (s) + 에너지 (열) ⇒ H2O (l)
⊙ 이것은 화학반응이라기 보다 물리적 변화이고 물리적 변화를 위해서도 에너지가 필요하다.

▣ 고체 소듐(나트륨)과 염소가 결합하면서 에너지(열과 빛) 방출
▣ 고체나트륨 : 2Na (s) + Cl2 (g) ⇒ NaCl (s) + 에너지 (빛과 열)
※ 고체나트륨은 공기와 반응성이 아주 좋다. 나트륨은 자르면 하해지고 그 순간 금속 빛이 나게 된다.
이 나트륨을 염소 기체에 넣게 되면 넣자마자 불이 확나고 엄청난 열과 빛을 내게 되고 남는 물질은 소금이 남게 된다.
▣ 모든 화학반응에는 에너지의 흡수 (흡열반응)나 방출 (발열반응)이 수반된다.
⇒ 즉, 항상 에너지가 관연하게 된다.
가. 에너지의 정의
▣ 에너지(Energy) : 일을 하거나 열을 전달할 수 있는 능력
▣ 에너지는 형태를 달리하면서 상호변환될 수 있으나 우주에서 에너지의 총량은 항상 일정하다.
⊙ 에너지 보존법칙 (Law of Conservation of Energy) : 열역학 제1법칙
나. 에너지의 형태

다. 에너지의 종류
1) 운동에너지 (Kinetic Energy)
▣ 운동 (Motion)에 의해 생기는 에너지
▣ 온도에 의존하는 열에너지도 이에 속함
▣ 에너지 산정식

2) 포텐셜 에너지 (Potential Energy)
▣ 물체의 위치 때문에 생성되는 에너지
⊙ 화학에너지 (Chemical Energy) : 원자들의 결합에 의해 저장되어 있는 에너지
⊙ 정전기에너지 (Electrostatic Energy) : 하전된 입자의 상호작용으로 생기는 포텐셜 에너지
▣ 에너지 변환의 예 : 댐 안에 갇힌 물방류 (PE) ⇒ 물이 발전기를 돌림 (kE) ⇒ 전기에너지의 형태로 공급
라. 에너지의 단위
▣ 에너지의 SI 단위 (과학적 공인 단위) : 줄 (J)
⊙ 물 1[g]을 1 [℃] 만큼 상승시키는데 필요한 에너지 : 1 [cal] = 4.184 [J]
⊙ 영양학적 칼로리는 킬로칼로리(kcal)를 사용하고 Cal로 표기함
▣ 열과 온도
⊙ 열 : 온도차에 의해 교환되는 에너지
⊙ 온도 : 물체의 차갑고 뜨거운 정도를 나타내는 척도
물체를 구성하는 입자들의 평균 운동에너지
ex) 물이 담겨 있는 두 플라스크 A (20[℃], 100 [g] 물), B (20[℃], 200 [g] 물)가 각각
의 온도가 30[℃]까지 상승하였다면 더 많은 열을 흡수한 플라스크는 어는 것일까 ? [답] B
2. 발열반응과 흡열반응
가. 계와 주위
▣ 계 : 일반적으로 관심을 가지고 있는 우주의 특정 부분, 화학에서는 변화가 일어나고 있는 물질을 포함한 반응 영역
▣ 주위 : 계 밖의 모든 우주
※ 우주 (Universe) = 계 (System) + 주위 (Surroundings)
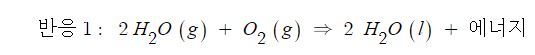
⊙ 계는 반응물과 생성물의 혼합물 (수소, 산소 및 물분자)
⊙ 계가 방출한 에너지는 소멸될 수 없으므로 주위에서 흡수
⊙ 열에너지가 계에서 주위로 이동하므로 발열 (exothermic) 반응

⊙ 열에너지가 주위에서 계로 공급되기 때문에 흡열 (endothermic) 반응

나. 계의 종류
▣ 열린 계 : 계와 주위 사이 에너지와 물질 모두 교환 가능
▣ 닫힌 계 : 계와 주위 사이 에너지의 교환은 가능하나 물질은 불가능
▣ 고립 계 : 계와 주위 사이 에너지와 물질 교환이 모두 불가능
(플라스크는 절연된 진공 커버로 둘러 싸임

다. 상태와 상태함수
▣ 계의 상태 : 물질의 조성, 에너지, 온도, 압력, 부피와 같이 관련된 모든 거시적 성질의 값
▣ 상태 함수 : 에너지, 온도, 압력, 부피
▣ 상태함수는 계의 상태에만 의존하기 때문에 그 변화의 값은 계의 초기 상태와 최종 상태에만 의존
ex) 손의 온도 : 37 [℃] ⇒ 40 [℃] ※ 손을 비빈다. 불에 손을 쬔다.

※ 상태함수 : 고도 (계단, 엘리베이터)
라. 열역학 제1법칙 (The first law of thermodynamics)
▣ 에너지는 한 형태에서 다른 형태로 전환될 수 있지만, 창조되거나 파괴될 수 없다는 것을 말함
U : 계의 내부 에너지, 상태함수이며 계를 구성하고 있는 모든 입자들의 에너지
(운동 + 포텐셜)의 합

ex : 황 1 [mol]과 산소 1 [mol] 이 반응하여 이산화황 1[mol] 이 생기는 반응은 ?

이 반응은 화학에너지의 일부가 열로 방출되므로 생성물의 내부 에너지 < 반응물의 내부
에너지 ∴ △U < 0
▣ 반응에서 열 방출 : 계에 포함된 화학에너지의 일부가 열에너지로 전환되었다는 점을 의미
U우주 = U계 + U주위
△U우주 = △U계 + △U주위
▣ 열역학 제1법칙에 따라 에너지는 보존되어야 하므로 우주의 에너지는 변화하지 않음
△U계 + △U주위 = 0
▣ 계에서 에너지 변화 △U계 가 일어나면, 우주의 나머지 부분인 주위의 에너지 변화는
계의 에너지 변화와 크기는 같으나 부호는 반대여야 함
△U계 = - △U주위
마. 일과 열
▣ 계가 열을 방출하거나 흡수할 때 또는 주위에 일을 하거나 주위로 부터 일을 받을 때 계의 내부 에너지 변화

⊙ q 는 열 (계가 방출하거나 또는 계가 흡수하는 )
⊙ w 는 일 (계에 대하여 하거나 또는 계가 하는)
⊙ q와 w는 상태함수가 아니지만 △U는 상태함수

⊙ 계가 열을 방출 : q < 0
⊙ 계가 열을 흡수 : q > 0
⊙ 계가 주위로 일을 하면 (부피증가) w < 0
⊙ 계가 주위에서 일을 받으면 (부피감소) w > 0
ex : 어떤 계가 187 [J]의 열을 흡수하고 주위에 142[J]의 일을 하였을 때 내부 에저지 변화 △U(Joules)를 구하시오.
△U계 = q + w = +187[J] - 142 [J] = +45 [J]
3. 엔탈피 (Enthalpy)

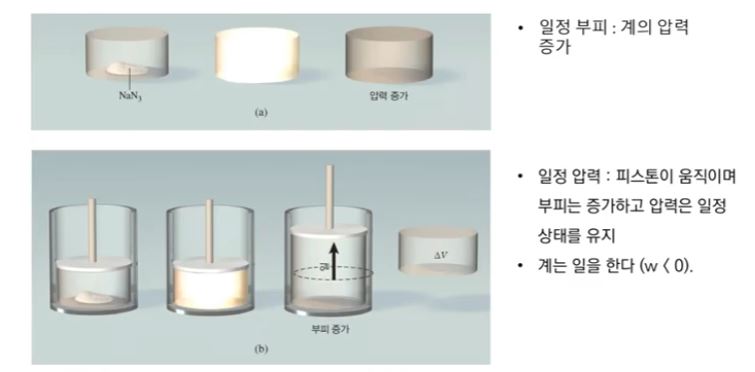
위 그림에서 쇼듐아자이트라는 물질인데 에어백에 넣는 성분이다.
살짝만 충격을 가해도 부풀어 오르는 성질의 화학물질이다.
만약에 이 물질을 반응시키는데 뚜껑을 완전히 닫고 했다면 이 물질은 고쳐였는데
기체로 변한다. 그러면서 압력이 크게 증가한다.
※ 움직이는 피스톤의 경우 외부 압력과 내부 압력이 같은 상태에서 운동이 정지된다.
가. 일 (Work)
▣ 물체를 이동시키는 힘(F)과 물체의 이동거리(d)의 곱
나. 팽창한 일 (압력 - 부피의 일 또는 PV일)

위 그림의 일과 압력의 관계를 식으로 나타내면 다음과 같다.

이 계에서 나타내는 압력은 힘을 면적으로 나눈 것이다. 따라서 밀어 올리는 힘을 구하려면
힘은 내부 압력에 면적을 곱하면 된다. 이때 밀어 올리는 힘 즉 내부압력은 외부 압려압력
과 같게 된다. 따라서 피스톤을 미는 힘은 마이너스 외부 압력 곱하기 면적이 되고 일은 힘
대신에 압력 곱하기 단면적을 쓰게 되면 마이너스 외부압력 곱하기 단면적 곱하기 거리가
된다. 그리고 그 밑에 있는 단면적과 이동거리를 곱하는 것은 알고 있는 부피의 변화를 의
미하고 따라서 계가 하는 일은 마이너스 압력 곱하기 부피변화가 된다.
이 때 단위가 중요하다. 1[J]은 1[kpa] 곱하기 1 [ℓ]이다.
여기서 우리는 1 [atm]이 101.3 [kpa]을 전제로 한다.
그러므로 일량은 1[atm] × 1[ℓ] = 101. 3 [J]임을 알 수 있다.

가. 내부 에너지 변화 vs 엔탈피 변화

※ 우리가 화학반응에서 나오는 열량을 측정할 때는 일정 압력이 훨씬 중요한 상태가 된다.
일정압력에서의 열량 변화 즉 엔탈피의 변화를 △H라고 한다.
그리고 일정 부피에서 열량 변화는 내부 에너지의 변화가 된다.
그러므로 일정 압력에서의 열량 변화는 엔탈피 변화 빼기 부피의 변화이다.
∴ △U = △H - P △ U
▣ 대부분의 반응은 일정 압력과정이기 때문에 계와 주위 사이에서 교환되는 열은 그 과정 의 엔탈피 변화와 동일하다.
△ H = H (생성물) - H (반응물)
△ H > 0 이면, 흡열반응
△ H < 0 이면, 발열반응
※ 대부분의 반응은 일정한 압력과정이기 때문에 계와 주위 사이에 교환되는 열은 그 과정에 엔탈피 변화이다.
왜냐하면 일정 압력에서 열량 변화가 엔탈피 변화라고 했을 때 엔탈피의 변화는 생성물이 가진 엔탈피에서
반응물이 가진 엔탈피를 빼면 되는데 사실 이런 생성물의 엔탈피 자체를 측정하기는 불가능하다.
왜냐하면 뭔가 열량 변화를 측정하려면 기준점이 있어야 되는데
이 엔탈피 같은 경우는 원자핵과 전자가 가진 에너지를 "0"으로 볼거냐 아니 면 안에 있는 양성자, 중성자, 전자
이 상태가 가진 에너지를 "0"으로 볼거냐 아니면 더 이제 미립자로 들어가서 위쿼크, 아래 쿼크가 갖는 에너지를
"0"으로 볼거냐 등 기준을 잡기가 어렵기 때문이다.
그러므로 엔탈피의 변화량의 값은 생성물 엔탈피에서 반응물 엔탈피를 빼는 것인데 엔탈피 자체를 측정하는 것은
불가능한 일이다. 항상 엔탈피 변화는 화학반응에서 출입하는 열을 얼마 만큼 내놨다. 그럼 엔탈피 변화가 얼마다.
생성물이 얼마 만큼 흡수했다 하면 엔탈피 변화가 얼마다 이런 식으로 표현할 수 있다.
△H 가 0보다 크면 흡열이고 0보다 작으면 발열이다.
△H가 0 보다 크다는 것도 계를 기본으로 한 것이다. 계의 입장에서는 생성물이 가진 열 이 0 보다 크다는 건
생성물이 가진 열이 반응물이 가진 열보다 크다는 것이니까 계는 그 만큼 열을 흡수한 것이다. 따라서 흡열반응이다.
반대로 △H가 0보다 작으면 생성물 이 가진 열량이 작아졌다는 것이므로 계 자체는 에너지를 잃은 발열반응이다.
4. 열량계와 열용량
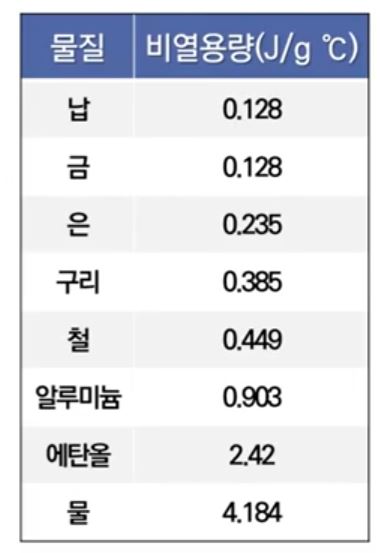
가. 비열용량과 열용량
1) 비열용량 (Specific heat Capacity. C)
▣ 물질 1[g]의 온도가 1 [℃] 만큼 올라 가는데 필요한 열의 양
⊙ 물의 비열은 거의 모든 물질에 비해 상당히 큼
ex : 더운 여름 집 앞에 물 뿌리기
낮에는 해풍 (바닷바람) & 밤에는 육풍 (육지바람)
2) 열용량 (Heat Capacity. C= cm)
▣ 물질의 온도를 1[℃] 올리는데 필요한 양
⊙ 비열용량 (비열)이 크면 온도변화에 저항하는 정도가 커서 온도가 서서히 올라 감
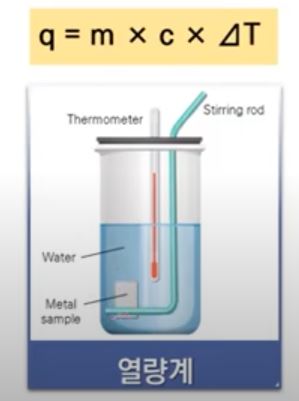
나. 열량 측정법
▣ 물질의 온도가 변화하였을 때 이동한 열에너지의 양은 다음 세 변수를 곱한 값이다.
【열 에너지 측정 공식】
⊙ 열 = 질량 × 비열용량 (비열) × 온도변화
⊙ q = m × C × △T
※ q : 열의 양 (J), m : 물질의 양 (g), C : 비열용량 (J/g. ℃), △T : 온도변화 [℃]
ex : 차 한잔을 만들기 위해 235[g] 의 물을 25[℃]에서 100[℃]까지 가열할 때 필요한 열량을 구하시오.
q = m × C × △T = 235 × 4.184 × 75 =7.4 × 104 [J]
ex : 일정한 양의 열을 이용하여 금속판을 가능한 한 높은 온도로 가열하고자 한다. 표에
있는 금속 중에서 어느 금속의 온도가 가장 높이 올라갈지 고르시오.

ex : 질량이 15.5[g]인 합금 덩어리를 98.9[℃]로 가열하여 물 25.0 [g]이 들어 있는 열량계에 넣었더니
온도가 22.5[℃]에서 25.7[℃]로 올라 갔다. 합금의 비열을 구하시오.
※ 물의 비열을 알고 있으므로 금속의 비열을 다음과 같이 구할 수 있다.
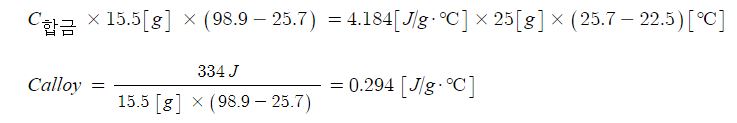
5. 열화학반응식
가. 열 화학 반응식
▣ 질량관계와 반응에 출입한 엔탈피 변화까지 보여주는 화학반응식
나. 열 화학 반응식의 특징
① 모든 반응물과 생성물의 물리적 상태를 상상 표시하여야 실제 엔탈피 변화를 알 수 있다.
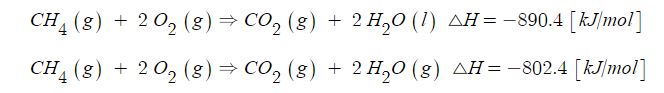
② 열 화학 반응식의 각 변에 n을 곱하면, △H도 n배 만큼 변해야 한다.

③ 반응식을 역으로 쓰면, 반응물과 생성물의 역할이 바뀌므로 △H의 크기는 같지만 부호는 바뀐다.

※ 흡열과정이었던 것이 역과정에서는 발열과정이 되고 발열과정은 흡열과정이 된다.
다. 헤스 (Hess)의 법칙
▣ 헤스(Hess)의 법칙
⊙ 엔탈피는 상태함수이므로 반응물이 생성물로 변하는 반응의 엔탈피 변화는 과정의
단계수와 상관없이 초기상태와 최종 상태만 일정하면 동일하다.
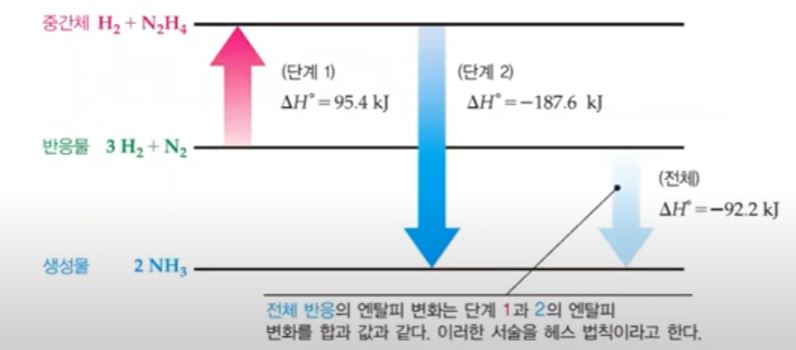
▣ 메테인이 연소하여 CO2(g)와 H2O(g)가 생성되는 반응
⇒ 이 반응은 다음과 같이 2단계에 걸쳐 일어난다.

ex : 다음 열화학 반응식을 이용하여 엔탈피 변화를 구하시오.