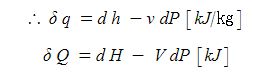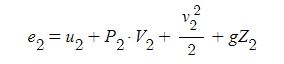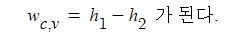1. 에너지 (energy)
▣ 에너지는 일을 할 수 있는 능력이라 할 수 있다.
▣ 에너지의 종류에는 운동에너지, 위치에너지, 내부에너지, 화학에너지, 전기에너지, 자기에너지 등 다양한 형태가 있다.
열역학 기초 부분에서 다루는 에너지의 형태는 다음과 같다.
⊙ 시스템이 가지는 에너지를 보통 E
⊙ 내부에너지 U
⊙ 위치에너지 Ep
⊙ 운동에너지 Ek
시스템의 에너지는 다음과 같다. (화학에너지 등 무시할 경우)
열역학에서 사용하는 여러가지 형탱의 에너지가 있으며 다음과 같이 요약하여 나타내고 있다.
⊙ 위치에너지 (Potential energy) : Ep는 보통 지구상에서의 높이차에 의한 에너지를 의미하며 일반적으로 절대값이
중요한 것이 아니고 차이가 중요하므로 기준 높이를 Zo 으로 하였을 경우 다음과 같다.
Ep = mg (Z - Zo)
기준높이를 Zo = 0 로 하였을 경우는 다음과 같다.
E = mgz

⊙ 운동에너지 (Kinetic energy) : Ek 는 물질의 운동과 관련되고 시스템의 속도가 V 일 때 운동에너지는 다음과 같다.

따라서 운동에너지와 위치에너지를 다시 쓰면 다음과 같다.

⊙ 위의 운동에너지와 위치에너지를 질량으로 나눈 단위 질량당 위치에너지와 운동에너지를 각각 ek, ep 로 나타내면
다음과 같다.

⊙ 역학적 에너지 (Mechanical energy) : 위치에너지와 운동에너지의 합을 역학적 에너지 또는 기계적 에너지라 한다.
시스템의 역학적 에너지를 Eme 라고 하면 다음과 같다.

⊙ 시스템의 단위 질량당 역학적 에너지를 eme 라고 하면 다음과 같다.

[보충설명]
검사체적(개방계)에서는 검사체적을 흘러들어 오고 나갈 때, 유동일을 추가적으로 고려하여야 하고 흐르는 유체의 압력에 의한 단위 질량당 유동 에너지 (또는 압력에너지)는
pv =P/ρ 이다.
따라서 이 경우 유동에너지를 포함한 단위 질량당 역학적 에너지는 다음과 같다.

또는 밀도 대신에 비체적을 사용하면 다음과 같이 나타낼 수 있다.

유체역학에서 사용하는 베르누이 방정식과 비교해 보자.

베르누이방정식에서 양변을 ρ로 나누어 주면 다음과 같다.

베르누이 방정식을 변형하여 나타낸 것이고 유체가 흐를 때 특별한 조건에서 이 역학적 에너지가 보존된다는 것이다.
⊙ 내부에너지 (Internal energy) : U 는 거시적으로는 측정되지 않는 분자운동 (병진운동 및 회전운동)이나 진동 등의
분자 차원에서 가지는 모든 에너지의 집합적 효과로 나타나는 주어진 상태에서 시스템이 원래 내부적으로 가지는 에너
지를 나타낸다. 온도가 높을 수록 이러한 운동이나 진동 등은 활발하기 때문에 온도가 높을 수록 내부에너지는 증가한
다.
⊙ 엔탈피 (enthalpy) : H 는 다음 처럼 내부에너지와 pV의 합으로 정의된다. 여기서 V는 부피이다. 엔탈피는 정압과정 중
에 밀폐계에 전달된 에너지 (열의 형태)는 엔탈피의 차이와 같고 또는 개방계에서 물질이 흘러 들어 오거나 나갈 때
관련되는 에너지 형태이다.
H = U + pV
⊙ 비내부에너지 (specific internal energy) : u 와 비엔탈피 (specific enthalpy) h는 다음 식처럼 단위 질량당 내부에너
지 및 단위 질량당 엔탈피를 나타낸다.

⊙ 비엔탈피 h는 비내부에너지 u와 다음의 관계가 있다.
h = u + pV ⇔ H = U + pV
⊙ 내부에너지나 엔탈피는 종량성 성질(상태량)이고 비내부에너지와 비엔탈피는 강성적 성질 (상태량)이다.
#에너지 #위치에너지 #운동에너지 #엔탈피 #기계적에너지 #내부에너지 #열역학
'소방설비기사 (기계) > 기초물리' 카테고리의 다른 글
| 특수 상대성 이론의 기본원리 : 마이컬슨-몰리실험, 상대성원리, 광속불변원리 (3) | 2024.08.20 |
|---|---|
| 열기관과 열효율 : 카르노기관, 영구기관 (0) | 2024.08.19 |
| 열역학 제1·2법칙 : 에너지보존법칙, 가역과정 · 비가역 과정 (0) | 2024.08.14 |
| 열역학 제1법칙 (등적 · 등압 · 등온 · 단열과정) (0) | 2024.08.13 |
| 응력 (Stress, σ), 응력의 측정 및 사용목적 (2) | 2024.08.12 |