1. 몰 (mol)과 아보가드로 수
몰(mol)은 원자의 양 (입자의 양)을 나타내는 단위이다.
아보가드로 수는 물질 1몰 (mol)에 포함되어 있는 기체 입자의 개수를 말한다.
물질 1몰 (mol) 속에 있는 입자의 개수는 6.02 × 1023 개이다.
만약, 물 분자 1몰에는 산소 원자 1몰과 수소원자 2몰이 들어 있게 된다.
각각의 원자 입자수는 몰수에 아보가드로 수를 곱하여 구할 수 있다.
물질의 입자 수 = 몰수 (mol) × 아보가드로 수 (개 /mol)
따라서 다음과 같이 구할 수 있다.
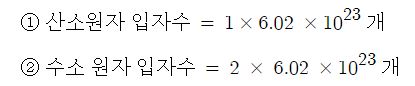
몰 질량은 물질 1몰의 질량을 말하며, 화학식에서 물질 1몰의 질량을 나타내며 단위로는 [g/mol]을 쓴다.
※ 아보가드로는 이탈리아의 과학자이다. 분자의 개념을 확립하였으며 아보가드로 법칙이라는 표준상태에서의
기체의 부피에 대한 가설을 수립하였다.
※ 표준 상태란 Standard Temperature and Pressure (STP)로 0 ℃ 1기압 상태를 말한다.
2. 몰 (mol)과 질량
몰질량은 입자 1몰을 포함하고 있는 부피의 질량을 말한다. 보통 화학식량에 그램 [g]을 붙인 값이다.
어떤 물질의 몰수는 그 물질의 질량을 몰질량이나 화학식량으로 나누어 구한다.

3. 몰 (mol) 과 부피
아보가드로 법칙은 압력과 온도가 모두 일정할 때 모든 기체상태의 물질은 같은 부피를 갖게 되고 그 속에 포함한 물질의 입자수도 같다고 한다.
이 때 몰 부피는 표준상태 (0℃, 1기압(atm))에서 모든 기체상태의 물질 1 몰 (mol)의 부피는 22.4 ℓ로 동일하다고 한다. 따라서 기체의 몰수는 다음 식으로 구할 수 있게 된다.
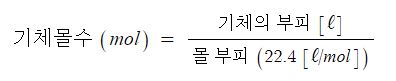
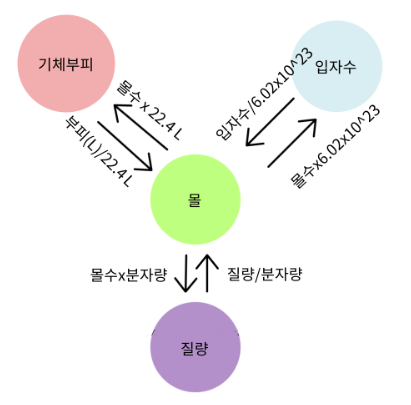
4. 몰(mol)과 질량, 부피, 입자수 사이의 관계
어떤 물질이 기체 상태일 때 몰 (mol)과 몰질량, 기체의 부피, 입자수 사이의 관계는 다음 그림과 같이 나타낼 수 있다.
#몰 #mol #몰질량 #몰부피 #아보가드로 #부피 #압력 #온도 #표준상태 #기압 #입자
#아보가드로수 #질량
'소방설비기사 (기계) > 기초물리' 카테고리의 다른 글
| 일반기체상수(R)와 특정기체상수(R')와의 관계 (0) | 2024.08.12 |
|---|---|
| 기체의 밀도와 몰질량 (이상기체 상태방정식) (0) | 2024.08.08 |
| 분류에 의해 작용하는 힘 (0) | 2024.08.07 |
| 운동량과 충격량 (Momentum & Impulse) (0) | 2024.08.07 |
| 베르누이 방정식과 토리첼리 정리 (0) | 2024.08.07 |
