1. 물의 전기 분해란?
2. 물의 전기 분해 화학반응식 분석
3. 전해질 원리 및 분석
물의 전기 분해란?
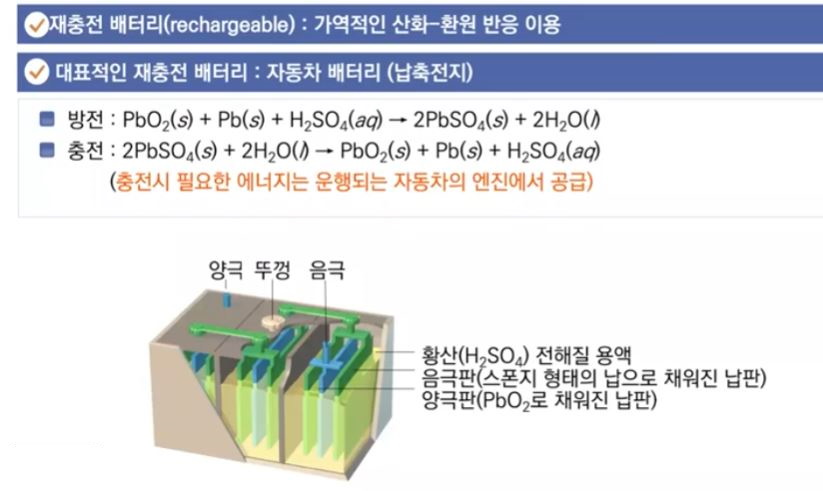
물의 전기 분해 장치는 다음과 같이 생겼습니다.

전원 장치에서 전류를 내보내고, 전극은
물과 연결되어 있습니다.
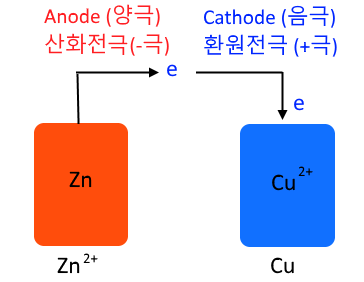
전자(e-)는 (-)극에서 (+)극으로 이동합니다.
각각의 전극은 유리관으로 덮어
발생하는 기체를 모으는 것이지요.
여기서 잠깐
H2O의 특징을 보자면,
물 분자(H2O) 중 매우 극소수는
H2O → H+ + OH-
스스로 "이온화"가 되는 특성이 있습니다.
(물의 자동 이온화)
이온화된, H+ 와 OH-가
각각의 전극에서
수소 기체와 산소 기체가 되는 것이지요.
또한,
물은 매우 극소수만 스스로 이온화되므로,
순수한 물은 전기전도성이 없습니다.
따라서
전류가 흐를 수 있도록
추가로 "전해질"을 넣어주어야 합니다.
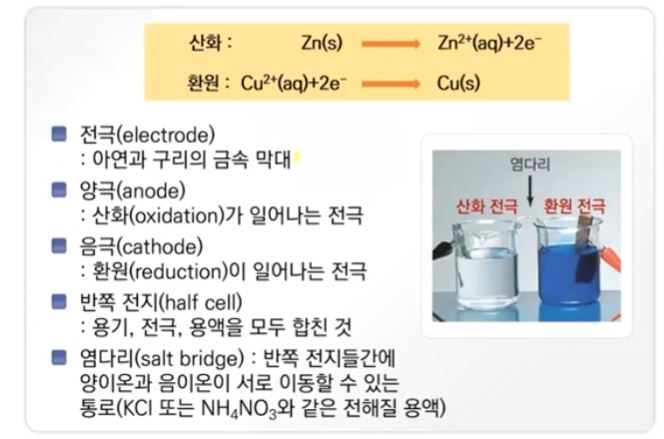
각각의 (+), (-) 전극은
(-)극 : H가 전자를 받음.
H2기체 생성↑
(+)극 : O가 전자를 잃음.
O2기체 생성↑
화학 반응식
2H2O → 2H2(-극) + O2(+극)
생성된 기체 부피비는
H2(g) : O2(g) = 2:1 로,
기체가 나오는 것을 알 수 있습니다.
각각의 기체는 다음과 같이 확인할 수 있지요?
산소 기체(O2)는 성냥 불씨가 잘 타오름.
수소 기체(H2)는 성냥이 펑 하고 터짐.
굉장히, 간단한 실험 같지만..
실제, 화학 반응에서 각 전극에서 일어나는
반응의 원리를 조금 더 심.층.적.으로 알아보겠습니다.
물의 전기분해 화학반응식 분석
고등학교 화학 공부를 하다 보면,
물의 전기 분해 반응식이
중학교 때 배운 반응식과 달리
상당히 복잡한 걸 알 수 있습니다.

...???!!
각 (+), (-)극에서 일어나는 반응이
너무도 생소하게 느껴지는군요..
원리를 설명하기 전에
전체 반응식을 정리해 보겠습니다.

화학반응식에서 각각의 반응식은
방정식처럼 더하고 빼는 방식이 가능합니다.
(헤스의 법칙)
반응식을 보면,
(+)극에서 얻은 전자(e-)의 수
=
(-)극에서 잃은 전자(e-)의 수
합하면 서로 "상쇄"되어 사라지지요?
각 반응식의 H+와 OH-는 합하면,
H2O분자가 되는군요.
4H+와 4OH-가 만나
4개의 물 분자(4H2O)가 생성된 걸 알 수 있습니다.
6H2O에서 생성된 4H2O를 빼주면,
최종적으로, "2H2O → O2 + 2H2" 로 정리 끝!
다음으로, (+), (-)극에서 일어나는
화학 반응식의 원리를 알아볼까요??
원리에 대해 알아보기에 앞서,
위에서 말했다시피,
H2O는 스스로 이온화가 되는 성질이 있습니다.
H2O → H+(수소이온) + OH-(수산화이온)
물의 자동 이온화
실질적으론 다음과 같지만,
2H2O → H3O+ + OH-
(H3O+ : 하이드로늄이온)
반응식과 설명을 간단히 하기 위해
위와 같이 나타내겠습니다.
이 극소수의 이온화된
H+와 OH-이 각각 (+)극과 (-)극에서
전자 이동이 일어나는 것이지요.
각각의 반응은 그림과 같습니다.

(+)극, (-)극에서 일어나는 물의 전기분해 반응
(+)극 반응
"(+)극"은 O의 전자를 전극에게 제공합니다.
(산화 반응)
H2O가 H+와 OH-로 이온화가 되면,
H+는 뺏길 전자가 없으니, pass!
OH-에서 전극에 전자(e-)를 제공합니다.
OH-는 H와 O로 이루어진 공유결합이지만,
전기음성도 개념에 의하면,
산소(O)는 수소(H)보다
전자를 잡아당기는 힘이 훨씬 강하답니다.
전기음성도 : 산소(O) : 3.5, 수소(H) : 2.1
따라서,
공유결합을 하고 있지만
실질적으론, H의 전자는 O에게
빼앗긴 격이 되는 것이지요.
OH-에서
산소(O)에 전자가 8개 (O2-)가 되겠지요??
여기서,
O의 여분의 "전자 2개"가
전극으로 빼앗기게 됩니다.
O2- → O + 2e-
이 산소 원자끼리 결합하여
산소기체 O2(g)를 생성하는 것이지요.
반응식으로 순서대로 정리하면 다음과 같겠습니다.
H2O → H+ + OH-
→ H+ + H+ + O +2e-
→ 2H+ + 1/2O2(g) + 2e-
(-)극 반응
"(-)극"은 전극에서 나오는 전자를
물질이 받는 반응(환원 반응)입니다.
마찬가지로,
H+와 OH-로 물이 이온화되었을 때,
이번엔,
전자를 받아야 하므로
OH-가 아닌, 전자가 부족한
H+가 전자를 받게 되는 것이지요.
위의 그림을 보면
H2O 하나 당 H+가 전자(e-) 1개를 받습니다.
H2O → H+ + OH- + e- → 1/2H2(g) + OH-
(+)극과 "잃고 얻은 전자의 수"를 맞추기 위해선
전체 반응을 2배를 해야겠군요.
2H2O + 2e- → H2(g) + 2OH-
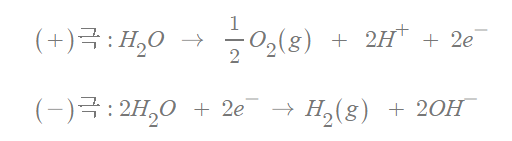
각각의 반응식에 x2를 해주면,
처음의 그림과 같은 화학 반응식이 나오는군요!!
(+)극은 OH-가 전자를 잃고(산화), O2(g) 생성
(-)극은 H+가 전자를 얻어(환원), H2(g) 생성
된다는 걸 알 수 있습니다.
최소 고등학교 화학1 이상의 개념이 필요하므로
중학교 학생들에겐 어렵게 느껴지겠습니당..
다음으로,
더욱 복잡한..
전해질의 원리를 알아볼까요??
전해질 원리 및 분석
전해질이란..?
전기 전도성이 없는 순수한 물(H2O)이
전류가 흐를 수 있도록 넣어주는 물질을
전해질이라 합니다.
전해질 원리를 그림으로 볼까요??

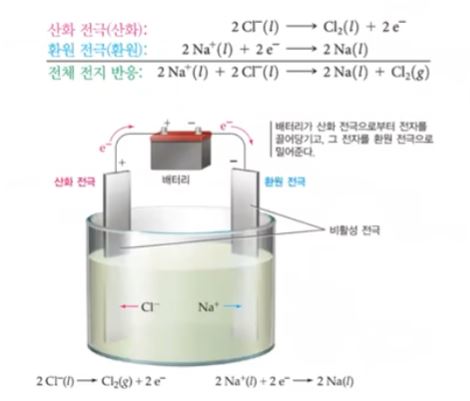
황산나트륨(Na2SO4)전해질의 흐름
전해질이 있는 수용액에 전류가 흐르면,
(-)극에서 오는 전자를 받기 위해,
양이온 (Na+)가 이동.
(+)극에 전자를 내보내기 위해,
음이온 (SO42-)가 이동.
그림과 같이 양이온과 음이온이
각각의 극으로 이동하여 전자를
제공받거나 제공하려 하지요.
but,
(-)극을 보면 실제로 전자(e-)를 제공받는 것은
Na+가 아닌 근처의 H+가 대신 제공받아
"H2가 생성"되는 것이지요.
Na+보다 H+가 더 전자를 받기 선호한다는 뜻.
(H+가 Na+보다 "환원"되려는 성질이 더 강함.)
(+)극도, SO42-가 전자를 제공하는 것이 아닌,
근처의 OH-이 전자를 제공하는 것이지요.
SO42-보다 OH-속 O가 전자를 더 제공하기 쉽다는 뜻.
(SO42-보다 OH-가 "산화"되려는 성질이 더 강함.)
다소 의미가 어렵지요??
다시 말해,
전해질의 양이온과 음이온이
H+, OH-와 전자를 받거나 얻는 과정에서
"경쟁"한다는 뜻입니다.
누가 더 전자를 원하는가..?! ㅇ.ㅇ
누가 더 산화, 환원되려는 성질이 강한가에 따라
전해질이 될 수도 있고 아닐 수도 있습니다.
예를 들어,
전해질이 염화 구리CuCl2(aq)를 보겠습니다.

(-)극에서 H+대신, Cu2+가 전자를 받게 되면서,
Cu가 (-)극에서 석출되어 버립니다.
Cu2+가 전자를 얻으려는 성질이 더 강함.
(+)극에서도 Cl-가 전자를 제공하게 되면서,
Cl2(g)가 나오게 됩니다.
Cl-가 전자를 제공하려는 성질이 더 강함.
따라서,
CuCl2는 물의 전기분해 실험에서
"부적합한 전해질"이 되는 것이지요...
그림을 보면 볼트(V)가 있는 걸 알 수 있듯이,
이쪽과 관련된 개념은
"전기화학 개념"이랍니다.
내용을 이해하기엔 다소 어려움이 있지요..
흔히, 우리가 아는 개념으로는
금속의 이온화 경향성 크기가 있습니다.
K > Ca > Na > Mg > Al > Zn … > H > Cu > Hg …
각각의 원소가
이온화되려는 경향의 크기를 나타내지요.
Na → Na+
H → H+
Cu → Cu2+
Na은 H보다
Na+로 남으려는 성향이 더 강하기 때문에,
(-)극에서 전자가 들어오면,
H+가 받게 되지만,
Cu는 H보다
Cu2+로 남으려는 성향이 더 약하므로,
(-)극에서 전자가 들어오면
H+보다 먼저 전자를 챙겨 "환원" 되는 것이지요.
고등과정에선 이 정도 선으로만, 이해하셔도 충분합니당.
원소마다 전자를 얻는 정도를
(물질이 환원되려는 정도)
1M, 1atm에서 "H+, 0V를 기준"으로
전압으로 나타내는
대표적인 "표준 환원 전위 표"가 있습니다.

간단히만, 설명하자면
각 물질이 "환원될 때의 전압"을 나타낸 것이랍니다.
전압(V)이 높을수록 "환원"이 잘 됨. (산화가 잘 안됨.)
전압(V)이 낮을수록 "산화"가 잘 됨. (환원이 잘 안됨.)
표에서 Na+를 보면, -2.71V군요.
산화되려는 성질이 강한 놈입니다.
(-)극에서 환원 반응이 일어날 때,
Na+, H2O, Cu2+
를 비교해 볼까요?
Na+ : -2.71V
(-)극 H2O 반응 : -0.83V
표에서, 2H2O + 2e- → H2 + 2OH- 참고
Cu2+ : +0.34V
"전압 크기 순서"로 정리하면,
Cu2+ > H2O > Na+
즉, Cu2+가 환원되려는(전자를 얻는)성향이
가장 강하기에 H+보다 Cu2+ 우선적으로
전자를 받아 Cu(s)으로 석출되는 것이지요.
(+)극은 OH-나 전해질의 음이온이
산화 반응(전자를 잃는)이 일어나는 곳이지요?
다시 말해
OH-보다 산화하려는 성향이 약해야,
OH-가 먼저 산화되겠지요.
산화가 약하다는 것은,
환원하려는 성질이 강하다는 것이지요?
환원되려는 성질이 강한 놈은
표에서 오른쪽 위에 있는 물질들입니다.
17족 원소인 F가 있지요.
+2.87V로 가장 높게 나타납니다.
이러한 물질들은 환원되려는 경향이 강하니
본인이 산화되기 싫어하는 물질입니다.
(+)극의 물의 반응에서
환원전위 값이 1.23V이니
이보다 더 높은 값을 갖는 물질들은
(+)극에 작용하는 음이온으로써
적합한 전해질이 될 수 있는 것이지요.
단!
표의 기준이 모두 들어맞는 것은 아닙니다.
Cl-와 같은 경우,
환원전위가 1.23V보다 높지만,
Cl-는 OH-보다, (+)극에서 먼저
산화되어 Cl2(g)를 생성하기도 합니다.
(Cl-는 부적합한 음이온)
위의 표와 달리
실제 분해반응에서 OH-가 산화하기 위해선
더 높은 전압이 요구되기 때문이지요..
이러한 현상을 과전압이라고 합니다.
표는 어느 정도 참고 자료가 될 뿐입니다.
전해질로 쓰일 수 있는 대표적인 음이온들은
표에는 없지만,
SO42-, NO3- 등이 있습니다.
이러한 놈들은 앵간해선 산화하지 않기 때문에,
(+)극에서, H2O의 OH-가 산화하게 되는 것이지요.
#전기분해 #전기화학 #음극 #양극 #산화 #전자 #음이온 #전해질
'위험물 기능장 > 일반화학및유체역학' 카테고리의 다른 글
| 지방족 탄화수소(Hydrocarbon) 유도체 (1) | 2024.12.08 |
|---|---|
| 탄화수소 (Hydrocarbon) (0) | 2024.12.08 |
| 당량과 당량수 (2) | 2024.12.03 |
| 산화수 (Oxidation state) 계산방법 및 규칙 (0) | 2024.12.03 |
| 몰농도, 몰랄농도, 퍼센트 농도 구하기 (0) | 2024.12.02 |