일반화학 및 유체역학 출제예상문제 -2
51. 0.2M - NH4OH 의 pH는 ? (단, 0.2M -NH4OH 용액의 이온화도는 0.01이고, log2 = 0.3 이다.)
① 10 ② 10.5 ③ 10.8 ④ 11.3
[풀이] [OH-] = [몰농도] × (염기의 기수) × (이온화도)
= 0.2 × 1 × 0.01 = 2 × 10-3

52. 0.001 M, HCl 용액의 pH는 얼마인가 ?
① 1 ② 2 ③ 3 ④ 4
[풀이] pH = - log [H+] = -log (1 × 10-3) = 3
53. 수산화 이온농도가 2.0 × 10-3 M인 암모니아 용액의 pH는 얼마인가 ? (단, log2=0.3)
① 10.3 ② 11.3 ③ 12.20 ④ 12.3
[풀이] pOH = -log [2.0 × 10-3] = 2.7
pH = 14.00 - pOH = 14.00 - 2.7 = 11.3
54. pH 4인 용액과 pH 6인 용액의 농도차는 얼마인가 ?
① 1.5 배 ② 2배 ③ 10배 ④ 100배
[풀이] pH 4 = 10-4, pH6 = 10-6 ∴ 100배
55. 브뢴스테드의 산, 염기 개념으로 다음 반응식에서 산에 해당되는 것은 ? ①

[풀이] 브뢴스테드의 산, 염기 개념
⊙ 산 : 양성자 (H+)를 내어 주는 물질
◈ NH3 +H2O → NH4+ + OH- : 염기 + 산 → 산 + 염기
◈ NH3 +H2O ← NH4+ + OH- : 염기 + 산 ← 산 + 염기
⊙ 염기 : 양성자 (H+)를 받을 수 있는 물질
56. 다음 물질의 수용액이 중성을 띠는 것은 ? ④
① KCl ② CaO ③ NH4Cl ④ KCl
[풀이] 강염기와 강산이 만나 생성하는 염은 중성이다.
57. 어떤 농도의 염산 용액 100 ㎖ 를 중화하는데 0.2 N, NaOH 용액 250㎖가 소모되었다. 이 염산의 농도는 ? ④
① 0.2 ② 0.3 ③ 0.4 ④ 0.5
[풀이] NV = N'V'
N × 100 = 0.2 × 250
∴ N = 0.5
58. 2M-H2SO4 용액 6ℓ에 4 M - H2SO4 4ℓ를 혼합했다. 이 혼합 용액의 농도는 ?
① 2 ② 2.4 ③ 2.8 ④ 3.2
[풀이] 혼합농도 산정식 : MV ± M'V' = M"(V+V')
(2×6)+(4×4) = M" × 10
10M"= 28, M" = 2.8
※ 혼합 용액의 성질이 같으며(산, 산), (염기, 염기) : +
혼합 용액의 성질이 다르면 (산, 염기) 중화반응으로 희석되므로 : ㅣ산-염기ㅣ
59. 산에도 반응하고, 강염기에도 반응하는 산화물은 ?
① CaO ② NiO ③ ZnO ④ CO
[풀이] 양쪽성 원소 : Al, Zn, Sn, Pb
60. NaOH(=40) 2g을 물에 녹여 500 ㎖ 용액을 만들었다. 이 용액의 몰농도는 ?
① 0.05M ② 0.1 M ③ 0.5 M ④ 1 M
[풀이] 몰 농도 M = 몰수 / 부피 (ℓ)
M = (2g / 40g/mol) / (0.5 ℓ/1ℓ) = 0.1 M
61. 0.2 N 염산 250 ㎖ 와 0.2 N 황산용액 250 ㎖ 를 혼합한 용액의 규정농도는 ?
① 0.2 N ② 0.3 N ③ 0.4 N ④ 2 N
[풀이] 노르말 농도 NV + N'V' = N" (V+V')
0.2 × 250 + 0.2 × 250 = N" (250+250)
500 N" = 50+50 N" = 0.2
※ 혼합 용액의 성질이 같으며(산, 산), (염기, 염기) : +
혼합 용액의 성질이 다르면 (산, 염기) 중화반응으로 희석되므로 : ㅣ산-염기ㅣ
62. 25℃ 에서 어떤 물질은 그 포화용액 300g 속에 50g이 녹아 있다, 이 온도에서 이 물질의 용해도는 얼마인가 ?
① 10 ② 20 ③ 30 ④ 40
[풀이] 용해도 = 용질 / 용매 × 100
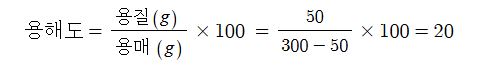
63. 20℃의 15% 소금물 100g 속에서는 소금이 몇 g 더 녹을 수 있는가 ? (단, 20℃ 에서 소금의 용해도는 약 36이다.)
① 15.6 ② 16 ③ 17 ④ 18
[풀이] 15%의 소금물 용액 100g = 소금(용질) 15 g + 물 (용매) 85 g
용해도 36 소금물 용액 136 g = 소금 36 g + 물 100 g
100 : 36 = 85 : x, 100 x = 36 × 85, x = 30.6
∴ 30.6 - 15 = 15.6g
64. 다음 중 용해도의 정의로 옳은 것은 ? ②
① 용액 100g 중에 녹아 있는 용질의 g당량수 ② 용매 100g에 녹아 있는 용질의 g수
③ 용매 1ℓ에 녹는 용질의 몰수 ④ 용매 100g에 녹아 있는 용질의 몰수
65. 소금 300g을 물 400g에 녹였을 때 수용액의 %는 ? ②
① 42 ② 43 ③ 44 ④ 45
[풀이] % 농도 = 용질 / 용액 × 100
% 농도 = [300 / (300 + 400)] × 100 = 42.86
66. 16%의 소금물 200g을 증발시켜 180 g으로 농축하였다. 이 용액은 몇 %인가 ? ③
① 17.58 ② 17.68 ③ 17.78 ④ 17.88
[풀이] % 농도 = 용질 / 용액 × 100 이므로 16%의 소금물 200g에는 32g의 소금이 들어 있다.
따라서 (32 / 180) × 100 = 17.78
67. 기체 암모니아를 25℃, 750㎜Hg에서 용적을 측정한결과 800㎖ 였다. 이것을 100㎖ 의 물에 전량 흡수시켜 암모니아
수용액을 만들 경우 중량백분률은 ?
① 0.52 ② 0.55 ③ 0.5526 ④ 0.6
[풀이] 암모니아 NH3 의 분자량 17, 이상기체 상태방정식 PV =w/MRT
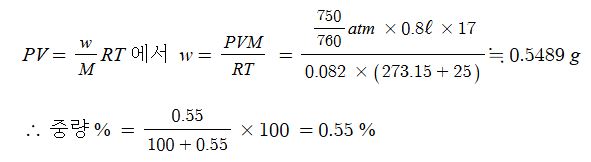
68. 0.2 M NaOH 0.5ℓ 와 0.3 M HCl 0.5 ℓ를 혼합한 용액의 몰농도는 ? ①
① 0.05M ② 0.05N ③ 1.15 M ④ 1.5 M
[풀이] 혼합농도 산정식 : MV ± M'V' = M"(V + V')
(0.3 × 0.5) - (0.2 × 0.5) = M" × (0.5 + 0.5)
M"= 0.15 - 0.1, M" = 0.05
※ 혼합 용액의 성질이 같으며(산, 산), (염기, 염기) : +
혼합 용액의 성질이 다르면 (산, 염기) 중화반응으로 희석되므로 : ㅣ산-염기ㅣ
69. 분자량이 120인 물질 10g을 물 100g 에 넣으니 0.5 M 용액이 되었다. 이 용액의 비중은 얼마인가 ? ①
① 0.66 ② 1.66 ③ 2.66 ④ 3.66

여기서, a : %농도, M : 분자량, S : 비중
70. 30%의 진한 HCl의 비중은 1.1이다. 이 진한 HCl의 몰농도는 얼마인가 ? ②
① 9 ② 9.04 ③ 10 ④ 10.04
[풀이] 몰농도 x = 1,000 × S × a/100 × 1/M
여기서, a : %농도, M : 분자량, S : 비중

71. 농도 96%인 진한 황산의 비중은 1.84이다. 진한황산의 몰농도는 ?
① 10 M ② 12 M ③ 16 M ④ 18 M
[풀이] 몰농도 x = 1,000 × S × a/100 × 1/M
여기서, a : %농도, M : 분자량, S : 비중, 황산 H2SO4의 분자량 98
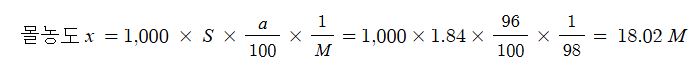
72. 분자량이120인 물질 6g을 물 94g에 넣으니 0.5M 용액이 되었다. 용액의 밀도는? ③
① 0.9 ② 0.95 ③ 1 ④ 1.2
[풀이] 몰농도 M = (용질질량/분자량) / (용매부피 ㎖ / 1000 ㎖)

73. 물 54g과 에탄올 (C2H5OH) 46g을 섞어서 만든 용액의 에탄올 몰분율은 얼마인가 ? ①
① 0.25 ② 0.3 ③ 0.4 ④ 0.5
[풀이] 물 몰수 : 54 / 18 = 3 mol, 에탄올 몰수 : 46 / 46 = 1 mol
∴ 에탄올 몰분율 = 1 / (3+1) = 0.25
74. 96% 황산으로 2N 황산 500㎖를 만들려고 한다. 이 황산은 약 몇 g이 필요한가 ? (단, 비중은 1로 가정한다) ②
① 50.04 ② 51.04 ③ 52.06 ④ 52.08
[풀이] 황산 1N = 49g 이므로 2N = 98 g 이다.
따라서, 1,000 : 98 = 500 : x 에서 x = 49 g 임을 알 수 있다.
이는 100% 황산의 경우 49g이 필요한 경우이며,
96%의 황산으로 만들려면 49 × 100 / 96 = 51.04g 이다.
75. 황산 수용액 1ℓ 중 순황산이 4.9 g 용해되어 있다. 이 용액의 농도는 얼마인가 ? ④
① 9.8 % ② 0.2 M ③ 0.2 N ④ 0.1 N
[풀이]
▣ 규정농도 · 당량농도라고도 하며, 용액 1ℓ 속에 녹아 있는 용질의 g 당량수로 나타낸다.
기호로는 N으로 표시하며 산 · 알칼리의 중화반응 또는 산화제와 환원제의 산화 · 환원반응의 계산 등에 사용한다.
⊙ 노르말 농도 = 몰 농도 × 가수 (당량수 (eq/mol))
▣ 황산 H2SO4 의 수용액은 2H+와 SO42-로 이온화 하므로 가수는 2이다.
몰농도는 (4.9/98)/1ℓ = 0.05 이다. 그러므로 노르말 농도 = 0.05 × 2 = 0.1 N 이다.
76. 어떤 물질 1.5g을 물 75g에 녹인 용액의 어느 점이 - 0.310 ℃ 였다. 이 물질의 분자량은 얼마인가 ? (단, 물의 몰내림은
1.86이다.) ④
① 200 ② 150 ③ 130 ④ 120
[풀이] 끓는 점 오름과 어느 점 내림

위 그림은 비휘발성 용질이 녹아 있는 수용액의 상평형 그림이다. 액체/증기 경계선이 순수한 물보다 더 높은 온도 쪽으로 이동해 있게 된다.
예상한 것처럼 끓는점 오름의 크기는 용질의 농도에 비례한다.
끓는점의 변화는 다음식으로 나타낼 수 있다.
ΔT = Kb · m
여기에서 △T는 끓는점 오름, 즉 용액과 순수한 용매 사이의 끓는점의 차이이며, Kb는 용매의 종류에 따라 결정되는 상수로서, 몰랄 끓는점 오름 상수라하고, m용질은 용액에 녹아 있는 용질의 몰랄 농도이다.
위 식에 대입을 하여 풀어 보면

77. 50g의 물속에 3.6g의 설탕 (분자량 : 342)이 녹아 있는 용액의 끓는점은 약 몇 ℃ 인가 ?
(단, 물의 몰오름은 0.513 이다) ③
① 100.23 ② 100.21 ③ 100.11 ④ 100.05
[풀이] 끓는 점 오름 : ΔT = Kb · m

78. 콜로이드 용액이 반투막을 통과하지 못하여, 정제하는데 사용하는 조작은 ? ③
① 브라운 운동 ② 틴들 ③ 투석 ④ 삼투막
[풀이] 투석(다이얼리시스) : 콜로이드가 반투막을 통과하지 못하는 현상
79. 다음 현상 중에서 헨리의 법칙으로 설명되는 것은 ? ①
① 사이다나 콜라의 병마개를 따면 거품이 난다. ② 높은 산 위에서는 물이 0 ℃ 이하에서 언다.
③ 바닷물은 0℃ 보다 낮은 온도에서 언다. ④ 극성이 큰 물질일 수록 물에 작 녹는다.
[풀이] 헨리의 법칙 : 기체의 용해도는 압력에 비례
80. 20℃ 의 물에 대한 설탕의 용해도는 204이다. 20℃ 의 물 500g에는 설탕이 몇 g까지 녹을 수 있는가 ? ①
① 1,020 ② 850 ③ 102 ④ 408
[풀이] 용해도(溶解度)는 용질이 용매에 포화 상태까지 녹을 수 있는 한도를 말하는데, 보통 용매 100g에 최대로 녹을 수
있는 용질의 양(g)을 의미한다. 온도, 용매와 용질 종류 등에 영향을 받는다. 대부분의 경우 온도가 높아질수록 고체
의 용해도는 증가하고, 기체의 용해도는 감소한다. 용해도를 표시할 때는 용질, 용매의 종류, 측정한 온도를 같이
표시해야 한다.
∴ 100 : 204 = 500 : x, 100 x = 204 × 500, x = 1,020 g
81. 80번 문제에서 설탕의 포화 수용액 속에 설탕의 중량은 몇 %인가 ? ④
① 55 ② 65 ③ 57.1 ④ 67.1
[풀이] 용해도는 용매 100g에 최대로 녹을 수 있는 용질의 g수 이므로 용해도 204의 포화수용액의 질량은 100 + 204 g
이다. 이에 대한 설탕의 중량비를 구하면 설탕의 중량비 = [204 / (100+204)] × 100 = 67.10 %
82. H2O + Cl2 → HCl + HClO 의 반응물 Cl2 의 변화는 ? ④
① 환원만 되었다. ② 산화만 되었다.
③ 산화와 환원 둘다 되지 않았다. ④ 산화도 되고 환원도 되었다.
[풀이] Cl2 는 산화수 "0"에서 HCl은 산화수 -1, HClO는 +1로 변화
83. 다음 화학반응 중 이산화황(SO2)이 산화제로 작용하는 것은 ? ③
① SO2 + H2O → H2SO4 ② SO2 + NaOH → NaHSO4
③ SO2 + 2H2S → 3S + 2H2O ④ SO2 + Cl2 + 2H2O → H2SO4 + 2H2O
[풀이] 이산화황이 환원되는 것을 찾으면 된다. ③ 의 경우에 이산화황이 산소를 잃는다.
84. 다음 중 H2SO4의 S에 대한 산화수는 ? ②
① +4 ② +6 ③ -5 ④ -4
[풀이] H+ × 2 = +2, O2- × 4 = -8
-8 + 2 + x = 0, x = +6
85. 과망가니즈산칼륨에서 Mn의 산화수는 ? ②
① +3 ② +7 ③ -3 ④ -7
[풀이] 과망가니즈산칼륨 KMnO4 에서 원소별 산화수를 살펴보면
K = +1, O = -2 이므로 +1 + x + -2 × 4 = 0, x = +7
86. 소금물을 전기분해할 때 음극에서 발생하는 기체는 다음 중 어느 것인가 ? ①
① H2 ② O2 ③ Cl2 ④ N2
[풀이] 음극 (-) : 2H+ + 2e- → H2 (환원)
양극 (+) : 2Cl- - 2e- → Cl2 (산화)
87. 1몰의 물을 완전히 전기분해하는데 필요한 전기량은 ? ②
① 1F ② 2F ③ 3F ④ 4F
[풀이] 1F(패럿)이란 물질 1g 당량을 석출하는데 필요한 전기량을 말한다.
화학반응에서는 수소원자 1g 또는 산소원자 8g과 반응하는 양을 1g당량이라 한다.

따라서, 1g 당량을 전기분해할 때 1F의 전기량이 필요하므로 2g 당량을 전기분해하는데 필요한 전기량은 2F이 된다.
88. CuSO4 용액에 0.5F의 전자를 흘렸을 때 약 몇 g의 구리가 석출되겠는가 ? ③ (단, Cu = 64, S = 32, O = 16)
① 20g ② 18g ③ 16 g ④ 14 g
[풀이] 1F의 Cu2+는 64/2 = 32 g이 1g 당량에 해당한다. 문제에서 0.5F의 전자를 흘렸으므로 32g × 0.5 = 16g 이다.
89. 물을 전기분해하여 표준상태에서 22.4ℓ의 산소를 얻는데 소요되는 전기량은 ?
① 4F ② 3F ③ 2F ④ 1F
[풀이] 물이 전기분해되는 경우 표준상태에서 산소(O2) 22.4ℓ는 32g이다.
산소 O2- 의 1g당량은 16/2 = 8g이다. 1F은 1g당량을 전기분해하는데 소요되는 전하량이다.
32g의 산소는 4g 당량에 해당한다. 따라서 소요되는 전하량은 1F × 32/8 = 4F이다.
90. CuSO4 용액에 7.8 A의 전류를 2시간 동안 통하면 Cu는 몇 g이 석출되겠는가 ? ② (단, CuSO4의 분자량 = 63.54)
① 17 ② 18.5 ③ 19.5 ④ 20
[풀이] 전기량 (C) = 전류(A) × 시간 (t : sec)
= 7.8 A × 2시간 × 3,600초 = 56,160C
전기량 1F에 의해 석출되는 Cu의 양 = 63.54 / 2 = 31.77g
96,500 : 31.77 = 56,160 : x
x = 18.49 g
※ 패럿(farad, 기호: F)은 전기용량의 국제단위이다. 마이클 페러데이의 이름을 따서 지어졌다.
화학에서 당량과 관련되어 쓰이는 다른 단위인 패럿(또는 패러데이 상수, 96,500 쿨룽)과 혼동될 여지가 있으나
다른 물리량이다.
91. 다음 중 상온에서 액체인 금속은 ? ②
① Br ② Hg ③ Pb ④ Ag
[풀이] 금속 중 상온에서 액체인 것은 수은(Hg)만이 유일하며, 다른 금속은 상온에서 고체로 존재한다.
92. CuSO4에 Zn을 넣으면 Cu가 석출된다. 그 이유는 무엇인가 ? ②
① 아연이 구리 보다 원자번호가 크기 때문이다. ② 아연이 구리 보다 이온화 경향이 크기 때문이다.
③ 아연이 구리보다 전자가 많기 때문이다. ④ 아연이 구리보다 단단하기 때문이다.
[풀이] 아연은 구리보다 이온화 경향이 크기 때문에 아연이 전자를 잃으면 그 전자를 구리이온이 얻어 구리로 석출된다.
93. 알칼리 금속 원소에 대한 설명으로 옳은 것은 ? ①
① 알칼리 금속은 주기율표상 1족 원소를 말한다. ② 물과 반응하여 산소 기체를 발생시킨다.
③ 매우 안정하여 반응성이 작다. ④ 반응성의 순서는 K < Na < Li 이다.
[풀이] 알칼리 금속 원소는 주기율표상 1족 원소이며 물과 반응하여 수소 기체를 발생시킨다.
94. 탄산칼슘(CaCO3)은 물에 녹기 어려운 고체이나, 이산화탄소를 포함한 물에는 조금 녹는다. 그 이유는 무엇인가 ? ④
① 탄산칼슘이 분해되기 때문에 ② 탄산성분이 생겨서 분해되기 때문에
③ 수산화칼슘이 녹기 때문에 ④ 탄산수소칼슘이 생기기 때문에
[풀이] CaCO3 + H2O + CO2 → Ca(HCO3)2
95. 묽은 염산을 가하면 기체를 발생시키는 금속은 ?
① Cu ② Au ③ Ag ④ Mg
[풀이] 금속의 이온화 경향
K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H) > Cu > Hg > Ag > Pt > Au
96. 질산은(AgNO3) 용액을 가했을 때 노란색 침전이 생기는 것은 ? ④
① HF ② HCl ③ HBr ④ HI
[풀이] 질산은(AgNO3) 용액은 HI와 반응하면 노란색 침전이 생성된다.
반면 HCl과 반응하면 흰색 앙금이 생성된다.
97. 할로겐 원소의 수소와의 결합력 세기를 옳게 표시한 것은 ? ①
① F > Cl > Br > I ② F > Br > I > Cl
③ I > Br > Cl > F ④ I > Cl > F > Br
98. 반감기가 5일인 물질 M(g)이 15일 후에는 얼마로 되겠는가 ? ②
① 1/16 M(g) ② 1/8 M(g) ③ 1/4 M(g) ④ 1/2 M(g)
[풀이]

99. 라돈(Rn)의 반감기는 3.8일이다. 1 × 10-2 g의 라돈이 19일 후에는 얼마나 남겠는가 ? ②
① 2.13 × 10-4 g ② 3.13 × 10-4 g ③ 4.05 × 10-6 g ④ 4.18 × 10-6 g
[풀이]

[풀이] β 입자 하나를 내놓으면 원자번호 1증가 , 질량수 변화는 없다.
#반감기 #원자번호 #전기분해 #헨리법칙 #삼투압 #몰분율 #몰농도 #중량백분률
#용해도 #산화물 #산화 #환원 #이온농도 #몰랄농도